Земноводные
Земново́дные[1][2], или амфи́бии[2][1] (лат. Amphibia), — класс четвероногих позвоночных животных, включающий в числе прочих тритонов, саламандр, лягушек и червяг и насчитывающий около 8 489[3][4] современных видов, из которых 87 % составляют бесхвостые. В России — 28 видов[5]. Обитают практически повсеместно (за исключением Антарктиды, Северного полюса и некоторых островов). В последние десятилетия по всему миру наблюдается резкое сокращение популяций земноводных: под серьёзной угрозой исчезновения находятся более 3045 видов.
Группа земноводных относится к наиболее примитивным наземным позвоночным, занимая промежуточное положение между наземными и водными позвоночными животными: размножение и развитие у большинства видов происходит в водной среде, а взрослые особи обитают на суше, тем самым относясь к анамниям. Земноводные являются важной частью экосистемы и употребляются в пищу многими более крупными хищниками. В индивидуальном развитии земноводные, как правило, проходят стадию живущей в воде личинки (у бесхвостых называемой головастиком). Личинки амфибий сохраняют многие черты строения, присущие рыбам, такие как наличие жабр, боковой линии, двухкамерного сердца. В ходе метаморфоза, головастики претерпевают значительные изменения: у них появляются конечности, жабры заменяются лёгкими, происходит перестройка кровеносной и выделительной систем. Большинство земноводных откладывают икру в воду; в то же время, некоторые виды откладывают икру на суше, а другие не проходят стадию головастика, являясь живородящими. Взрослые особи большинства видов являются хищниками, чья диета состоит из мелких беспозвоночных (крупные виды могут питаться и небольшими позвоночными), но существуют также и всеядные виды и даже несколько видов, питающихся фруктами. Взрослые земноводные дышат лёгкими, также они могут дышать и водопроницаемой кожей, а у некоторых мелких саламандр и лягушек нет лёгких, и дышат они только кожей. Внешне они похожи на рептилий, таких как ящерицы или змеи, но, наряду с млекопитающими и птицами, пресмыкающиеся являются амниотами, в отличие от амфибий.
Самые ранние амфибии произошли в девонский период — более 370 млн лет назад — от лопастепёрых рыб с лёгкими, что помогло им приспособиться к суше. Земноводные разнообразились и стали доминирующими животными в каменноугольный и пермский периоды, но позже были вытеснены рептилиями и другими позвоночными. Происхождение современных представителей класса является дискуссионным, но, вероятно, они произошли от темноспондилов — группы доисторических амфибий пермского периода.
Главные признаки земноводных — слизистая, гладкая и водопроницаемая кожа, период метаморфоза (превращения из личинки во взрослое животное), подвижные веки, хладнокровность и необходимость воды для размножения. Современные земноводные имеют упрощённую анатомию по сравнению с их предками из-за двух эволюционных тенденций: миниатюризацией и необычно большим геномом, что приводит к более медленному росту и скорости развития по сравнению с другими позвоночными. Земноводные — экзотермные (холоднокровные) позвоночные, у которых температура тела не поддерживается за счёт внутренних физиологических процессов. Их скорость метаболизма низкая, и в результате их потребности в пище и энергии ограничены. У них мускулистые языки, которые у многих видов бесхвостых могут выстреливать изо рта для ловли добычи. Современные земноводные имеют полностью окостеневшие позвонки с суставными отростками. Их рёбра обычно короткие или отсутствуют вовсе (у бесхвостых). Черепа современных амфибий в основном широкие и короткие, часто не полностью окостеневшие и содержащие большое количество хряща. Кожа земноводных слабо ороговевает и не покрыта чешуёй, за исключением некоторых червяг. Кожа содержит много слизистых желёз, а у некоторых видов ядовитые железы (разновидность зернистых желёз). Сердце амфибий трёхкамерное, состоит из двух предсердий и одного желудочка. Амфибии, ведущие пресноводный образ жизни, в качестве продуктов азотистого обмена выделяют аммиак (аммониотеличный обмен), а наземные формы — мочевину (уреотеличный обмен)[2]. Большинство амфибий откладывают яйца в воду.
Самая маленькая амфибия (и позвоночное животное) в мире — лягушка из Папуа—Новой Гвинеи Paedophryne amauensis длиной всего 7,7—8 мм. Самая крупная из ныне живущих амфибий — китайская исполинская саламандра длиной 1,8 м и массой 70 кг; вымершие прионозух и мастодонзавр достигали в длину 6—9 метров и весили около двух тонн. Современные же представители класса, как правило, невелики. Земноводные, наряду с пресмыкающимися, являются традиционным объектом изучения герпетологии, однако иногда выделяют и самостоятельную науку — батрахологию.
Классификация
Слово «амфибия» происходит от древнегреческого термина ἀμφίβιος (amphíbios), что означает «оба вида жизни». Термин первоначально использовался как общее название для животных, способных жить на суше и в воде, в том числе ластоногих и выдр. Традиционно, класс амфибий включает в себя всех четвероногих позвоночных, которые не являются амниотами. Амфибии в самом широком смысле (sensu lato) были разделены на три подкласса, два из которых являются вымершими[6]:
- † Подкласс Лабиринтодонты (Labyrinthodontia — отдельная палеозойская и раннемезозойская группа)
- † Подкласс Тонкопозвонковые (Lepospondyli — небольшая палеозойская группа, иногда включается в лабиринтодонтов, которая фактически может быть ближе родственна амниотам, чем беспанцирным)
- Подкласс Беспанцирные (Lissamphibia — все современные амфибии, включая лягушек, жаб, саламандр, тритонов и червяг)
- Отряд Бесхвостые земноводные (Anura — лягушки и жабы): с юрского периода по настоящее время — 7 560 ныне живущих видов в составе 48 семейств
- Отряд Хвостатые земноводные (Caudata или Urodela — саламандры, тритоны): с юрского периода по настоящее время — 774 ныне живущих вида в 10 семействах
- Отряд Безногие земноводные (Gymnophiona или Apoda — червяги): с юрского периода по настоящее время — 190—245 ныне живущих видов в 10 семействах
Фактическое количество выделяемых видов в каждой группе зависит от используемой таксономической классификации. Двумя наиболее распространёнными системами являются: классификация, принятая на веб-сайте AmphibiaWeb Калифорнийского университета в Беркли, и классификация герпетолога Даррела Фроста и Американского музея естественной истории, доступная как онлайн база данных Amphibian Species of the World[7]. Количество известных видов по Фросту составляет около 8,5 тысяч, из которых около 90 % составляют лягушки[8].
Согласно филогенетической классификации подкласс лабиринтодонты рассматривается как парафилетическая группа, не имеющая уникальных определяющих признаков[9].

Классификации отличаются в зависимости от предпочитаемых их авторами филогенетических методов и способов определения клад. Традиционно класс земноводные определяется как все четвероногие с личиночной стадией развития, а группу, включающую в себя общих предков всех ныне существующих земноводных (лягушек, саламандр и червяг) и всех их потомков, принято называть беспанцирными (Lissamphibia). Филогения палеозойских амфибий неопределённа, и беспанцирные, возможно, принадлежат к ныне вымершей группе — темноспондильные (традиционно помещается в подкласс лабиринтодонтов) или к тонкопозвонковым, а в некоторых работах — даже к амниотам. Таким образом, сторонники филогенетической номенклатуры исключили из состава амфибий большое количество групп вымерших амфибиоподобных четвероногих девонского и каменноугольного периодов, ранее включаемых в их состав систематики Карла Линнея[10]. Если общий предок амфибий и амниот включён в класс земноводных, то они оказываются парафилетической группой наряду с рыбами, ящерицами и т. п[11].
Все современные амфибии включаются в подкласс беспанцирные, который обычно считается кладой — группой видов, произошедших от общего предка. Однако было высказано предположение, что саламандры возникли отдельно от темноспондилоподобных предков, а червяги являются сестринской группой передовых рептилиоморфных земноводных, а следовательно — амниотами[12].
Хотя известно несколько более древних окаменелостей прото-лягушек, древнейшей «истинной лягушкой» считается Prosalirus bitis, из нижнеюрских отложений формации Кайента в Аризоне, США. Анатомически она сходна с современными лягушками[13]. Древнейшая известная ископаемая червяга Eocaecilia micropodia из раннего юрского периода также найдена в Аризоне[14]. Древнейшей известной ископаемой саламандрой является Beiyanerpeton jianpingensis из верхнеюрских отложений северо-восточного Китая[15].
Беспанцирные традиционно разделяются на три отряда; однако вымершее семейство саламандроподобных земноводных Albanerpetontidae также включается в состав этого надотряда. Прыгающие[9] также включают в себя ископаемый вид прото-лягушки Triadobatrachus из триаса[16].
Бесхвостые
Отряд Anura (от древнегреческого а (н) - что означает «без» и оура — «хвост») включает лягушек и жаб. У них обычно длинные задние конечности, более короткие передние конечности, перепончатые пальцы без когтей, без хвоста, большие глаза и железистая влажная кожа. Членов этого отряда с гладкой кожей обычно называют лягушками, а с бородавчатой кожей — жабами. Различие не является формальным таксономически, и из этого правила есть многочисленные исключения[9]. Большинство видов живут в воде или влажной местности, но некоторые приспособились для жизни на деревьях или в пустынях. Встречаются по всему миру, за исключением полярных областей[17].

Бесхвостые делятся на три подотряда, которые приняты научным сообществом, но отношения между некоторыми семействами остаются неясными. Будущие молекулярные исследования должны обеспечить дальнейшее понимание их эволюционных взаимоотношений. Подотряд Archaeobatrachia включает четыре семейства примитивных лягушек. Это Ascaphidae, Bombinatoridae, Discoglossidae и Leiopelmatidae, которые имеют мало производных признаков и, вероятно, являются парафилетическими по отношению к другим видам лягушек. Шестью семействами в более эволюционно продвинутом подотряде Mesobatrachia являются Megophryidae, Pelobatidae, Pelodytidae, Scaphiopodidae и Rhinophrynidae, а также Pipidae. У них есть определённые характеристики, которые занимают промежуточное положение между двумя другими подотрядами. Neobatrachia на сегодняшний день является крупнейшим подотрядом и включает оставшиеся семейства современных лягушек, включая наиболее распространённые виды. Девяносто шесть процентов из более чем 7,5 тысяч существующих видов лягушек принадлежат к этому подотряду[18][19].
Ниже представлена кладограмма эволюционных взаимоотношений семейств отряда, предложенная в 2006 году[20]:
| Anura |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hyloides |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ranoides |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Хвостатые

Отряд Caudata (от лат. cauda) состоит из саламандр и тритонов — животных с вытянутым телом, похожим на ящериц. Это симплезиоморфный признак, и они не более тесно связаны с ящерицами, чем с млекопитающими[21]. Саламандры лишены когтей, имеют кожу без чешуи, гладкую или покрытую бугорками и хвосты, которые могут быть плоскими. Саламандры обитают в основном в Евразии. Семейство Plethodontidae встречается также в Центральной и Южной Америке к северу от бассейна Амазонки; в Южную Америку, по-видимому, хвостатые прибыли из Центральной Америки примерно в начале миоцена, 23 миллиона лет назад. Члены нескольких семейств саламандр стали педоморфными и либо не могут завершить свой метаморфоз, либо сохраняют некоторые личиночные характеристики во взрослом состоянии[22]. Они могут быть наземными или водными, и многие проводят часть года в каждой среде обитания. На суше они в основном проводят день, прячась под камнями, брёвнами или в густой растительности, выбираясь вечером и ночью в поисках корма: червей, насекомых и других беспозвоночных[23].
Подотряд Cryptobranchoidea включает примитивных саламандр. Было обнаружено несколько ископаемых скрытожаберных, но живых видов всего три: китайская гигантская саламандра (Andrias davidianus), японская гигантская саламандра (Andrias japonicus) и аллеганский скрытожаберник (Cryptbranchus alleganiensis) из Северной Америки. Эти крупные амфибии во взрослом состоянии сохраняют несколько личиночных характеристик; имеются жаберные щели, глаза открыты. Самцы выкапывают гнёзда, самки откладывают туда икру, а самцы её охраняют. Помимо дыхания лёгкими, они дышат через множество складок тонкой кожи, которая имеет тонкие капилляры[24][25].
Подотряд Salamandroidea включает более развитых саламандр. Они отличаются от скрытожаберных сросшимися предсуставными костями нижней челюсти и размножением внутреннего оплодотворения. Самым большим семейством в этой группе являются Plethodontidae, саламандры без лёгких, которые включают 60 % всех видов саламандр. Семейство Salamandridae включает настоящих саламандр, а название «тритон» дано членам его подсемейства Pleurodelinae[9].

Третий подотряд, Sirenoidea, включает четыре вида сирен, принадлежащих к одному семейству Sirenidae . Представители этого отряда — угреподобные водные саламандры с сильно редуцированными передними конечностями и без задних конечностей. Оплодотворение, вероятно, внешнее, поскольку у сиренид отсутствуют клоакальные железы, используемые самцами саламандр для производства сперматофоров, а у самок отсутствуют сперматеки для хранения спермы. Несмотря на это, яйца откладываются поодиночке, что не способствует внешнему оплодотворению[26].
Кладограмма, изображающая родственные связи между современными семействами хвостатых земноводных согласно Pyron and Wiens (2011)[27].
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Безногие
Отряд Gymnophiona (от др.-греч. gymnos, голый и ophis, змея), или Apoda включает червяг. Это длинные, цилиндрические, безногие животные змеевидной или червеобразной формы. Кожа червяг имеет большое количество поперечных складок, а у некоторых видов содержит крошечные вросшие кожные чешуйки. У них есть рудиментарные глаза, покрытые кожей, которые, вероятно, отличают только свет и тьму. Около глаза расположена пара коротких щупалец, которые имеют осязательную и обонятельную функции. Большинство червяг живут под землёй в норах во влажной почве, в гнилой древесине и под растительными остатками, но некоторые из них являются водными[9]. Большинство видов откладывают яйца под землёй, а когда вылупляются личинки, они сами плывут в местные водоёмы. Другие высиживают свои яйца, и личинки претерпевают метаморфоз до того, как вылупятся из икры. Некоторые виды рожают живых детёнышей, питая их железистым секретом, пока они находятся в яйцеводе[28]. Червяги встречаются в тропических регионах Африки, Азии, Центральной и Южной Америки[29]. Однако, эта систематика по всей вероятности не отражает все эволюционные родственные отношения. Точное количество родов и видов внутри отдельных семейств колеблется в зависимости от авторов, в особенности из-за того, что многие виды описаны лишь по одному-единственному экземпляру. Однако в любой систематике по меньшей мере две трети всех видов относятся к семейству настоящих червяг (Caeciliidae)[30].
Ниже представлено эволюционное древо безногих земноводных согласно исследованию, опубликованному San Mauro et al в 2014 году, которое базировалось на молекулярных данных митохондриального генома[31].
| Gymnophiona |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
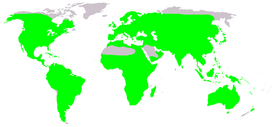
Ареал
Земноводные распространены практически на всей суше. Исключения составляют большие песчаные пустыни Сахара и Руб-Эль-Хали, наиболее холодные области — Гренландия, Таймыр и другие высокоширотные районы Арктики, Антарктида, а также некоторые острова, удалённые от континентов[32][33]. Кроме того, естественный ареал земноводных не включал южный остров Новой Зеландии, но после нескольких попыток искусственного внедрения по крайней мере два вида (Litoria raniformis и Litoria ewingii) основали на нём устойчивые популяции[34]. Жаб-аг завезли в Океанию для уничтожения вредителей, что не является её естественным ареалом. Многие виды имеют ограниченное распространение из-за климатических или географических барьеров, например, проливов, горных хребтов, пустынь; популяции могут быть изолированы также из-за препятствий, созданных человеком — автотрасс, лесных просек и т. п.[35] В тропических регионах видовое разнообразие, как правило, выше, чем в районах с умеренным климатом[36]. Некоторые виды земноводных адаптированы для выживания в негостеприимных условиях, например, в пустынях[37] или в холодном климате. Так, Rana sylvatica, чей ареал частично лежит за северным полярным кругом, на зиму закапывается в землю. Несмотря на глубокое промерзание почвы, высокая концентрация глюкозы в тканях позволяет этой лягушке пережить зиму в состоянии анабиоза[38].
Из-за водопроницаемой кожи большинство амфибий неспособны жить с солёных и солоноватых водоемах. Единственное исключение — крабоядная лягушка, обитающая в мангровых зарослях Юго-Восточной Азии. Благодаря высокому содержанию мочевины в крови эта лягушка и её головастики могут переносить океаническую солёность (в течение короткого времени) и длительное время жить в солоноватой воде. В солоноватой воде иногда встречается также жаба-ага[1].
Эволюция

Земноводные относятся к наиболее примитивным наземным позвоночным, занимая промежуточное положение между наземными и водными позвоночными животными, что отражается в их онтогенезе: размножение и эмбриональное развитие у большинства видов происходит в водной среде, а взрослые особи обитают на суше[1].

Первые прародители земноводных развились в девонский период, около 370 миллионов лет назад из лопастных рыб, которые были похожи на современных латимерий и двоякодышащих рыб[39]. У этих древних морских обитателей развились многосуставчатые, похожие на ноги плавники с пальцами, которые позволяли им ползать по морскому дну. У некоторых рыб развились примитивные лёгкие, которые помогали им дышать воздухом. Они также могли использовать свои сильные плавники, чтобы подняться из воды на сушу, если того потребуют обстоятельства[40]. В конце концов, их костные плавники стали превращаться в конечности, тем самым положив начало жизни на суше. Несмотря на способность ползать по суше, многие из этих доисторических рыб — тетраподоморфов по-прежнему проводили большую часть своей жизни в воде. У них начали развиваться лёгкие, похожие на лёгкие современных земноводных, но они все ещё дышали преимущественно жабрами[41][42].

Было обнаружено много видов, которые уже не являлись рыбами, но и ещё не были земноводными. Ихтиостега была одной из первых примитивных земноводных с ноздрями и более эффективными лёгкими. У неё было четыре крепких конечности, шея, хвост с плавниками и череп, очень похожий на череп кистепёрой рыбы Eusthenopteron[39]. Кожа земноводных стала способной удерживать жидкость организма и сопротивляться высыханию. Кость в подъязычной области за жабрами уменьшилась в размерах и превратилась в стремечко уха земноводных, приспособление, необходимое для слуха на суше[41]. Основное сходство между земноводными и костистыми рыбами заключается в многоскладчатой структуре зубов и парных верхнезатылочных костях, ни один вид не имеет таких особенностей в современном животном мире[43][44].
В конце девонского периода (360 миллионов лет назад) моря, реки и озера кишели жизнью, в то время как земля была царством растений и лишена позвоночных, хотя некоторые рыбы (например, ихтиостега) порой выходили на сушу. Считается, что они, возможно, передвигались передними конечностями, волоча заднюю часть подобно тому, как это делают сегодня морские слоны. В начале каменноугольного периода (от 360 до 345 миллионов лет назад) климат стал влажным и тёплым. Образовались обширные болота с мхами, папоротниками, хвощами и каламитами. Появились первые членистоногие, тем самым являясь пищей плотоядным амфибиям, которые начали приспосабливаться к земной среде. Других четвероногих на суше не было, и земноводные находились на вершине пищевой цепи, занимая экологическое положение, которое в настоящее время занимает крокодил. Они были главными наземными хищниками, иногда достигая нескольких метров в длину (например, гигантский прионозух), охотились на крупных насекомых того периода и на множество видов рыб в воде. Однако развивающимся земноводным по-прежнему нужно было возвращаться в воду, чтобы отложить яйца без скорлупы, и до сих пор большинство современных земноводных откладывают яйца в воде или около неё. Именно развитие икры в воде, которое предотвращает высыхание развивающегося эмбриона, позволило рептилиям размножаться на суше и привело к их господству в последующий период[39].
После коллапса тропических лесов в каменноугольном периоде амфибии уступили место рептилиям, и первые стали исчезать[45]. В триасовый период (от 250 до 200 миллионов лет назад) рептилии продолжали вытеснять земноводных, что привело к уменьшению как размера земноводных, так и их значения в биосфере. Согласно летописи окаменелостей, Lissamphibia, надотряд, который включает в себя всех современных земноводных, которые являются единственными сохранившимися до наших дней, возможно, ответвились от вымерших групп Temnospondyli и Lepospondyli в какой-то период между поздним карбоном и ранним триасом. Относительная нехватка ископаемых свидетельств препятствует точному датированию[41], однако самое последнее молекулярное исследование, основанное на многолокусном типировании последовательностей, предполагает позднекаменноугольное или раннепермское происхождение современных амфибий[46].


Происхождение и эволюционные отношения между тремя основными группами амфибий являются предметом споров. Молекулярная филогения 2005 года, основанная на анализе рДНК, предполагает, что саламандры и червяги более тесно связаны друг с другом, чем с лягушками. Также представляется, что расхождение трёх групп произошло в палеозое или раннем мезозое (около 250 миллионов лет назад), до распада суперконтинента Пангеи и вскоре после их расхождения с кистепёрыми рыбами[47]. Краткость этого периода и скорость, с которой произошла радиация, могут помочь объяснить относительную редкость окаменелостей примитивных амфибий. Существуют большие пробелы летописи окаменелостей. Ископаемые остатки Vieraella herbsti были обнаружены в 1961 году в Аргентине и датируются возрастом около 175 миллионов лет (на рубеже ааленского и тоарского ярусов юрского периода). Строение тела Vieraella близко к современным бесхвостым и он считается (наряду с чуть более древним Prosalirus bitis) одним из самых древних их представителей, полностью адаптированным для передвижения прыжками. Некоторые исследователи считают Vieraella самой древней из настоящих лягушек и датируют его возрастом 188—213 миллионов лет. Обнаружение Gerobatrachus из ранней перми в Техасе в 2008 году также дало недостающее звено со многими характеристиками современных лягушек[48]. В 2008 году в нижнепермских отложениях Техаса была найдена его окаменелость (а именно вида Gerobatrachus hottoni) возрастом в 290 млн лет. Это животное было отнесено к темноспондильным амфибиям, однако оно обладало смесью характеристик, присущих бесхвостым и хвостатым земноводным. Эта находка, по мнению описавших её исследователей, заполнила брешь между мезозойскими бесхвостыми и хвостатыми земноводными и их палеозойскими предками. Она также указывала на то, что хвостатые и бесхвостые земноводные ближе друг к другу, чем к безногим земноводным[49][50]. Молекулярный анализ показывает, что расхождение между лягушкой и саламандрой произошло значительно раньше, чем указывают палеонтологические данные. Одно исследование предположило, что последний общий предок всех современных амфибий жил около 315 миллионов лет назад, и что стереоспондильные темноспондильные являются ближайшими родственниками червяг. Тем не менее, большинство исследований поддерживают единую монофилетическое происхождение всех современных земноводных в пределах диссорофоидных темноспондилов[48][51][52].
По мере того, как земноводные эволюционировали из рыб, амфибии приобретали приспособления для жизни на суше. В воде их толкал вперёд хвост. Их позвоночник, конечности, пояса конечностей и мускулатура должны были быть достаточно сильными, чтобы отрывать их от земли для передвижения и кормления. Земноводным нужно было справиться с колебаниями температуры окружающей среды. Их кожа подвергалась воздействию лучей опасного ультрафиолета, которые при водной жизни поглощались самой водой. Поэтому кожа амфибий изменилась, чтобы защищать от солнца и предотращать выделение жизненно необходимой жидкости[53][54].
Строение и физиология
Размеры

Самое маленькое земноводное (и позвоночное животное) в мире — это лягушка из Папуа—Новой Гвинеи Paedophryne amauensis, впервые обнаруженная в 2012 году длиной всего 7,7—8 мм[55]. Вид Paedophryne amauensis был включён Международным институтом исследования видов[en] в список «Десять самых замечательных видов» за 2013 год как мельчайшее из известных позвоночных. Самая крупная из ныне живущих амфибий — 1,8-метровая китайская исполинская саламандра, но она намного меньше, чем самая крупная из когда-либо существовавших земноводных — вымершая 9-метровая амфибия прионозух, похожий на крокодила темноспондил, живший 270 миллионов лет назад в Бразилии. Самая крупная лягушка — африканская лягушка-голиаф, которая может достигать 32 см в длину и весить 3 кг[56]. Весьма крупная также роющая африканская лягушка. Это один из крупнейших бесхвостых животных на планете, уступающий только лягушке-голиафу: самцы весят до 1,4 кг и вырастают до 24,5 см в длину. Размеры крупных безногих земноводных могут достигать полутора метров. Так, крупнейший зарегистрированный экземпляр исполинской червяги достигал в длину 1,52 м. Самые мелкие представители этого отряда относятся к видам Idiocranium russeli и Grandisonia brevis. Взрослые представители этих видов достигают в длину 98—104 мм и 112 мм соответственно[57][58].
Кожные покровы

Все земноводные имеют гладкую и тонкую кожу, сравнительно легко проницаемую для жидкостей и газов. Через неё происходит газообмен, что позволяет взрослым амфибиям дышать, не поднимаясь на поверхность воды, а также впадать в спячку на дне водоёмов. Чтобы увлажнять тонкую и нежную кожу, у земноводных развились слизистые железы, в основном на голове, спине и хвосте. Выделение слизи помогает сохранять кожу увлажнённой. Кроме того, у большинства видов амфибий имеются зернистые железы, выделяющие неприятные на вкус или ядовитые вещества. Некоторые токсины земноводных могут быть смертельными для человека, в то время как другие не наносят большого вреда. Основные вырабатывающие яд железы, паротиды, вырабатывают нейротоксины, такие как буфотоксин, и располагаются за ушами у жаб, вдоль спины у лягушек, за глазами у хвостатых и на спине у безногих амфибий[9].

Как и других позвоночных животных, в коже земноводных выделяется многослойный эпидермис и собственно кожа (дерма, или кориум). Кожа богата железами, выделяющими слизь. У некоторых слизь может быть ядовитой или облегчающей газообмен. Кожа является дополнительным органом газообмена и снабжена густой сетью капилляров. Роговые образования очень редки, также редки и окостенения кожи: у седлоносной жабы и у рогатых лягушек, например бразильской рогатки, есть костяная пластинка в коже спины, у безногих земноводных имеются чешуйки; у жаб в коже с возрастом иногда отлагается известь[59][60][61][62].
Эпидермис состоит из 2—3 слоёв клеток у личинок и 5—7 слоёв у взрослых особей. Клетки наиболее глубокого базального слоя непрерывно делятся и обеспечивают возобновление кожи. У большинства взрослых в ходе метаморфоза земноводных появляется роговой слой, клетки которого уплощаются и ороговевают. Роговой слой обеспечивает защиту от механических повреждений[63]. Роговой слой периодически обновляется в процессе линьки, контролируемой гипофизом и щитовидной железой. У некоторых представителей, например жаб, на коже имеются местные утолщения (часто называемые бородавками). Наружная часть кожи сбрасывается в основном целиком, в отличие от млекопитающих и птиц, у которых она отслаивается хлопьями. Отслоившуюся кожу земноводные часто поедают[17]. В более толстой дерме залегают слизистые и зернистые железы, пигментные клетки, а также кровеносные сосуды и нервы[63].

Цвет кожи земноводных определяется тремя слоями пигментных клеток, называемых хроматофорами. Эти три слоя клеток состоят из меланофоров (занимающих самый глубокий слой), гуанофоров (образующих промежуточный слой и содержащих много гранул, дающих сине-зелёный цвет) и липофоров (жёлтый, самый поверхностный слой). Изменение цвета, наблюдаемое у многих видов, инициируется гормонами, выделяемыми гипофизом. В отличие от костистых рыб, нервная система не контролирует пигментные клетки напрямую, в результате чего изменение цвета происходит медленнее, чем у рыб. Ярко окрашенная кожа обычно указывает на то, что этот вид ядовит, и является предупреждающим знаком для хищников[64][65].

Скелет
Земноводные имеют скелетную систему, которая структурно идентична другим четвероногим, хотя и с рядом вариаций. Все амфибии имеют четыре конечности, за исключением безногих червяг и нескольких видов саламандр с редуцированными конечностями или без них. Кости полые и лёгкие. Опорно-двигательный аппарат крепкий, чтобы поддерживать голову и тело. Кости полностью окостенели, а позвонки сцеплены друг с другом посредством перекрывающихся отростков. Грудной пояс поддерживается мышцами, а хорошо развитый тазовый пояс прикрепляется к позвоночнику парой крестцовых рёбер. Подвздошная кость наклонена вперёд, и тело держится ближе к земле, чем у млекопитающих[66].
Тело разделено на голову, туловище, хвост (у хвостатых) и пятипалые конечности. Голова подвижно соединена с туловищем.
Скелет разделён на отделы:
- осевой скелет (позвоночник);
- скелет головы (череп);
- скелет парных конечностей.
В позвоночнике выделяют 4 отдела: шейный, туловищный, крестцовый и хвостовой. Число позвонков — от 7 у бесхвостых до 200 у безногих земноводных[67].
Шейный позвонок подвижно причленяется к затылочному отделу черепа (обеспечивает подвижность головы). К туловищным позвонкам прикрепляются рёбра (кроме бесхвостых, у которых они отсутствуют). Единственный крестцовый позвонок соединён с тазовым поясом.
У бесхвостых позвонки хвостового отдела срастаются в одну кость[9].
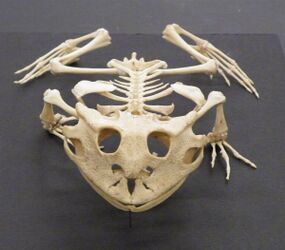
Скелет конечностей образован скелетом пояса конечностей и скелетом свободных конечностей. Плечевой пояс лежит в толще мускулатуры и включает парные лопатки, ключицы и вороньи кости, соединённые с грудиной. Скелет передней конечности состоит из плеча (плечевая кость), предплечья (лучевая и локтевая кости) и кисти (кости запястья, пястья и фаланги пальцев). Тазовый пояс состоит из парных подвздошных, седалищных и лобковых костей, сросшихся между собой. Он прикреплён к крестцовому позвонку через подвздошные кости. В состав скелета задней конечности входят бедро, голень (большая и малая берцовая кости) и стопа (кости предплюсны, плюсны и фаланги пальцев). У бесхвостых кости предплечья и голени сливаются. Все кости задней конечности сильно удлинены, образуя мощные рычаги для передвижения прыжками[68][69].
Мышечная система
Мускулатура подразделяется на мускулатуру туловища и конечностей. Туловищная мускулатура сегментирована. Группы специальных мышц обеспечивают сложные движения рычажных конечностей. На голове расположены поднимающие и опускающие мышцы. У лягушек, например, мышцы лучше всего развиты в области челюстей и конечностей. У хвостатых земноводных также сильно развиты хвостовые мышцы[70].
Мышечная система амфибий под влиянием наземного образа жизни претерпела значительные изменения. Однообразно построенные сегменты мускулатуры рыб преобразованы в дифференцированные мышцы конечностей, головы, ротовой полости[1].
Органы дыхания
Органами дыхания у земноводных являются:
- лёгкие
- кожа и слизистая выстилка ротоглоточной полости (дополнительные органы дыхания);
- жабры (у некоторых водных обитателей и у головастиков)[71].
У большинства видов (кроме безлёгочных саламандр и лягушек Barbourula kalimantanensis) имеются лёгкие не очень большого объёма, в виде тонкостенных мешков, оплетённых густой сетью кровеносных сосудов. Каждое лёгкое открывается самостоятельным отверстием в гортанно-трахейную впадину (здесь расположены голосовые связки, открывающиеся щелью в ротоглоточную полость). Дыхание происходит за счёт изменения объёма ротоглоточной полости: воздух поступает в ротоглоточную полость через ноздри при опускании её дна. При поднимании дна воздух проталкивается в лёгкие. У жаб, приспособленных к обитанию в более засушливой среде, кожа ороговевает, и дыхание осуществляется преимущественно лёгкими[43].


Лёгкие земноводных примитивны по сравнению с лёгкими амниот, имеют несколько внутренних перегородок и большие альвеолы и, следовательно, имеют сравнительно низкую скорость диффузии кислорода, поступающего в кровь. Обмен кислородом осуществляется за счёт буккально воронки. У взрослых дыхание происходит в результате действия насоса: животное сначала всасывает воздух в рото-глоточную полость через наружные ноздри. Вдыхаемый воздух заполняет рот и горло до того, как предыдущий вдох покидает лёгкие, опуская горло с закрытой голосовой щелью. Только тогда воздух из лёгких покидает тело амфибии через ноздри. Амфибия сужает или закрывает наружные ноздри. Мышцы горла сокращаются. Воздух изо рта и глотки поступает в лёгкие через открытую голосовую щель. Голосовая щель снова закрывается, воздух остаётся вне рта и глотки. Они запасают ещё воздуха перед выдохом. Механизм последнего отличается от вдоха: воздух выталкивается гибкими лёгкими и движениями стенки туловища. Однако последние происходят реже, чем движения горла[72][9]. Однако большинство земноводных способны обмениваться газами с водой или воздухом через кожу. Чтобы обеспечить достаточное кожное дыхание, поверхность кожи должна оставаться влажной, чтобы кислород мог диффундировать с достаточно высокой скоростью. Поскольку концентрация кислорода в воде увеличивается как при низких температурах, так и при высоких скоростях потока, водные амфибии в этих ситуациях могут полагаться в первую очередь на кожное дыхание. Титикакский свистун может всю жизнь дышать кожей. Многие водные саламандры и все головастики имеют жабры на личиночной стадии, а некоторые (например, аксолотль) имеют жабры во взрослом состоянии[70].
Земноводные разработали более разнообразные структуры для газообмена (внешние жабры, внутренние жабры, лёгкие, кожа), чем любой другой класс позвоночных[9].
Личинки земноводных обычно обитают в воде, поэтому для дыхания они используют жабры. Они осуществляют газообмен, забирая кислород из омывающей их воды, которая поступает в организм через рот или ноздри, нагнетаемые горловыми движениями. Жабры есть и у животных, у которых отсутствуют плавающие в воде личинки. Тихоокеанская саламандра, относящаяся к лёгочным саламандрам, живородяща и имеет большие мясистые жабры[9].
Обычно жабры исчезают при метаморфозе. Исключение составляют американские протеи рода Necturus. Также среди видов, представители которых в обычно теряют жабры, есть неотенические особи, сохраняющие их. Многие представители отряда хвостатых имеют жабры[9].
У взрослых земноводных есть единственная трахея, которая несёт воздух из голосовой щели в лёгкие, также также имеется гортанная трахея. Это короткий участок дыхательных путей. Лёгкие часто несимметричны, хотя это существуют и исключения (например, Typhlonectes Compressicauda, которая имеет хорошо развитые лёгкие с обеих сторон). Однако правое лёгкое Ichthyophis orthoplicatus, например, в четыре раза больше левого. У Hypogephis rostratus правое лёгкое хорошо развито, а левое лёгкое находится в зачаточном состоянии. Эта тенденция зашла ещё дальше у Boulengerula taitanus, у которого есть только одно лёгкое. Длинное правое лёгкое, простирающееся от половины до трёх четвертей длины тела, при этом левое лёгкое составляет менее 10 %, типично для наземных видов. У бесхвостых земноводных не было зарегистрировано ни одного вида без лёгких[9][73].
Лёгкие земноводных кажутся примитивными по сравнению с амниотами. Их внутренняя поверхность образует сложные складки. Между ними находятся камеры, то есть лёгочные пузыри, где происходит газообмен. Несколько альвеолярных перегородок разделяют большие альвеолы (иногда их вообще не считают альвеолами). Размер лёгочных мешков лягушки составляет 150—600 мкм. Они выстланы эпителием, образованным клетками 1 типа (некоторые авторы различают два типа клеток, покрытым слоем сурфактанта [74][73].
Большинство земноводных способны осуществлять газообмен через кожу как в воде, так и на воздухе. Лёгочное дыхание сохраняется относительно постоянным в течение года, тогда как интенсивность кожного дыхания отчётливо возрастает весной и летом и снижается зимой. Слизистая оболочка полости рта также участвует в газообмене. Чтобы обеспечить достаточное дыхание через кожу, поверхность сильно васкуляризированной кожи должна оставаться влажной, позволяя молекулам кислорода диффундировать с достаточной скоростью. Поскольку концентрация кислорода в воде увеличивается при низких температурах, водные амфибии в этих условиях полагаются в основном на газообмен, осуществляемый через кожу. Они в основном небольших размеров (что означает большое отношение площади поверхности тела к его объёму), но не характеризуются чрезмерно развитой сетью капилляров в коже. У Batrachoseps он развит даже слабо. Это компенсируется большим количеством ядерных эритроцитов (отсутствие ядра означает большее количество гемоглобина, несущего кислород. У некоторых видов, например Dicamptodon ensatus дорсальные капилляры вдвое толще вентральных. Во время сезона размножения у самца волосатой лягушки развиваются волосовидные придатки кожи, которые играют роль в функционировании наружных лёгких[28][9].
Подводя итог, земноводные могут дышать лёгкими, кожей и ртом[75][76].
- Разные виды безлёгочных или с особыми приспособлениями (волосатая лягушка) амфибий
Органы кровообращения

Кровеносная система замкнутая, сердце трёхкамерное[77] со смешиванием крови в желудочке (кроме безлёгочных саламандр, которые имеют двухкамерное сердце). Температура тела зависит от температуры окружающей среды (являются холоднокровными животными)[78].
Кровеносная система состоит из большого и малого (лёгочного) кругов кровообращения. Появление второго круга связано с приобретением лёгочного дыхания. Сердце состоит из двух предсердий (в правом предсердии кровь смешанная, преимущественно венозная, а в левом — артериальная) и одного желудочка. Внутри стенки желудочка образуют складки, препятствующие смешиванию артериальной и венозной крови. Из желудочка выходит артериальный конус, снабжённый спиральным клапаном[79].
- кожнолёгочные артерии (несут венозную кровь к лёгким и коже);
- сонные артерии (снабжают артериальной кровью органы головы);
- дуги аорты несут смешанную кровь к остальным органам тела.
Малый круг — лёгочный, начинается кожно-лёгочными артериями, несущими кровь к органам дыхания (лёгким и коже); от лёгких обогащённая кислородом кровь собирается в парные лёгочные вены, впадающие в левое предсердие. Большой круг кровообращения начинается дугами аорты и сонными артериями, которые ветвятся в органах и тканях. Венозная кровь по парным передним полым венам и непарной задней полой вене попадает в правое предсердие. Кроме того, в передние полые вены попадает окисленная кровь от кожи, и поэтому кровь в правом предсердии смешанная. Помимо обычного сердца у всех земноводных есть лимфатические сердца, которые расположены перед местами впадения в вены лимфатических сосудов[80].
У земноводных есть ювенильная стадия и взрослая стадия, и системы кровообращения у них разные. На стадии молоди (или головастика) кровообращение похоже на кровообращение рыбы; двухкамерное сердце перекачивает кровь через жабры, где она насыщается кислородом, и распространяется по телу и обратно к сердцу по единой петле. На взрослой стадии земноводные (особенно лягушки) теряют жабры и у них развиваются лёгкие. У них есть сердце, состоящее из одного желудочка и двух предсердий. Когда желудочек начинает сокращаться, деоксигенированная кровь перекачивается через лёгочную артерию в лёгкие. Затем продолжающееся сокращение перекачивает насыщенную кислородом кровь по всему телу[81].
Органы пищеварения
Все земноводные питаются только подвижной добычей. На дне ротоглоточной полости находится мускулистый язык. У бесхвостых он передним концом прикрепляется к нижним челюстям, при ловле насекомых язык выбрасывается изо рта, к нему прилипает добыча; длина языка у самых крупных достигает 7-11 сантиметров. Большинство амфибий проглатывают свою добычу целиком, не пережёвывая её, потому что у них объёмный желудок. Короткий пищевод выстлан крохотными отростками, которые помогают продвигать пищу в желудок, а слизь, вырабатываемая железами рта и глотки, облегчает её прохождение. На челюстях имеются зубы, служащие только для удержания добычи. У лягушек они расположены только на верхней челюсти, а у представителей семейства настоящие жабы они вообще отсутствуют[82]. Единственным видом бесхвостых, имеющим зубы на обоих челюстях является квакша Гюнтера из рода Аmphignathodon, называемая ещё как полнозубая квакша[83][1]. Доказано, что нижние зубы отсутствовали уже у предка всех современных лягушек около 230 млн лет назад, и возникли заново у этого вида 5-17 млн лет назад. Таким образом, эта лягушка даёт пример нарушения закона Долло[84].
В ротоглоточную полость открываются протоки слюнных желёз, секрет которых не содержит пищеварительных ферментов. Из ротоглоточной полости пища по пищеводу поступает в желудок, оттуда в двенадцатиперстную кишку. Сюда открываются протоки печени и поджелудочной железы. Переваривание пищи происходит в желудке и в двенадцатиперстной кишке. Тонкий кишечник переходит в прямую кишку, которая образует расширение — клоаку. Так же имеется жёлчный пузырь, накапливающий в себе выработанную печенью жёлчь[9].
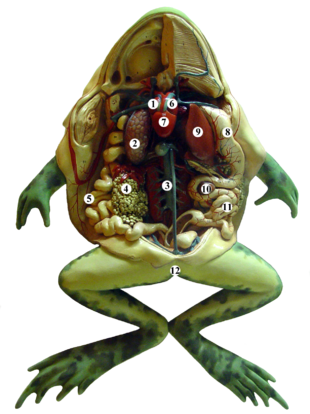
Земноводные обладают поджелудочной железой, печенью и желчным пузырём. Печень обычно крупная. Его размер определяется его функцией в качестве единицы хранения гликогена и жира и может меняться в зависимости от времени года по мере того, как эти запасы накапливаются или расходуются. Жировая ткань является ещё одним важным средством хранения энергии, и это происходит в брюшной полости (во внутренних структурах, называемых жировыми телами), под кожей и, у некоторых саламандр, в хвосте[9].
Органы выделения
Органы выделения — парные туловищные почки, от которых отходят мочеточники, открывающиеся в клоаку. В стенке клоаки имеется отверстие мочевого пузыря, в который стекает моча, попавшая в клоаку из мочеточников. В туловищных почках не происходит обратного всасывания воды. После наполнения мочевого пузыря и сокращения мышц его стенок концентрированная моча выводится в клоаку и выбрасывается наружу. Своеобразная сложность такого механизма объясняется необходимостью земноводных сохранять большее количество влаги. Поэтому моча не удаляется сразу из клоаки, а попав в неё, предварительно направляется в мочевой пузырь. Часть продуктов обмена и большое количество влаги выделяется через кожу[9].
Две почки расположены дорсально полости тела. Их работа состоит в том, чтобы фильтровать кровь от метаболических отходов и транспортировать мочу через мочеточники в мочевой пузырь, где она хранится, прежде чем периодически выходить через клоакальное отверстие. Личинки и большинство взрослых водных амфибий выделяют азот в виде аммиака в больших количествах разбавленной мочи, в то время как наземные виды, нуждающиеся в большей экономии воды, выделяют менее токсичный продукт, мочевину. Некоторые древесные лягушки с ограниченным доступом к воде выделяют большую часть отходов своего метаболизма в виде мочевой кислоты[85].
Личинки и большинство взрослых амфибий, ведущих водный образ жизни, выделяют азот в виде аммиака, растворённого в большом количестве разбавленной мочи. Амфибия способна вырабатывать такое большое количество мочи благодаря значительной скорости клубочковой фильтрации (её снижение — один из первых эффектов обезвоживания амфибии) и высокой реабсорбционной способности канальцев. С другой стороны, наземные формы, хотя скорость клубочковой фильтрации у них даже выше, чем у водных, вынуждены в большей степени экономить воду, выделяя менее токсичную мочевину. Этот парадокс объясняется тем, что, в отличие от водных амфибий, они могут в значительной степени полагаться на почки для выделения продуктов азотистого обмена. Водные земноводные в основном используют для этого кожу. Кроме того, почечные канальцы также могут реабсорбировать воду, что обусловлено действием антидиуретического гормона (хотя и в гораздо меньшей степени, чем у млекопитающих)[9][86].
Эти особенности не позволили земноводным полностью перейти к наземному образу жизни[9].
Нервная система
В сравнении с рыбами вес головного мозга земноводных больше. Вес головного мозга в процентах от массы тела составляет у современных хрящевых рыб 0,06—0,44 %, у костных рыб 0,02—0,94, у хвостатых земноводных 0,29—0,36, у бесхвостых 0,50—0,73 %[87].
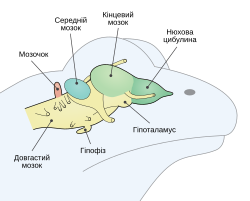
Головной мозг земноводных относительно прост, но структурно такой же, как у рептилий, птиц и млекопитающих. Их мозг удлинён, за исключением червяг, и содержит обычные двигательные и сенсорные области третрапод. Считается, что шишковидное тело вырабатывает гормоны, участвующие в спячке[9].
Состоит из 5 отделов[88]:
- передний мозг относительно крупный; разделён на 2 полушария; имеет крупные обонятельные доли;
- промежуточный мозг хорошо развит;
- мозжечок развит слабо в связи с несложными, однообразными движениями;
- продолговатый мозг является центром дыхательной, кровеносной и пищеварительной системы;
- средний мозг относительно невелик, является центром зрения, тонуса скелетной мускулатуры.
Передний мозг, даже без обонятельных луковиц, у представителей семейств настоящие лягушки и жабы составляет 40 % массы мозга, у хвостатых и того больше — у видов рода Амбистомы 56 %[88]. Передний мозг состоит из двух полушарий. Эти полушария делятся на дорсальную и вентральную области, а те, в свою очередь, на латеральную и медиальную. Летаральная и медиальная области делятся на дорсальные, латеральные и медиальные[88].
От головного мозга отходят 10 пар черепных нервов (I—X)[88].
Спинномозговые нервы у хвостатых и бесхвостых образуют хорошо выраженные плечевое и поясничное сплетения. Хорошо развита симпатическая нервная система, представленная в основном двумя симпатическими нервными стволами, расположенными по бокам позвоночного столба[88]. Спинной мозг имеет парные корешки спинномозговых нервов: задний - чувствительный, и передний - двигательный. Их количество варьируется у различных групп амфибий, например у бесхвостых их обычно 10-11 пар. У взрослых представителей двух других отрядов современных амфибий их количество больше, как и у личинок, теряющих хвосты и развивающих конечности[88].
Органы чувств

Глаза приспособлены к функционированию в воздушной среде. У земноводных глаза похожи на глаза рыб, однако не имеют серебристой и отражательной оболочек, а также серповидного отростка. Недоразвиты глаза только у протеев. У высших земноводных есть верхние (кожистые) и нижние (прозрачные) подвижные веки. Мигательная перепонка (вместо нижнего века у большей части бесхвостых) выполняет защитную функцию. Слёзные железы отсутствуют, но есть гардерова железа, секрет которой смачивает роговицу и предохраняет её от высыхания. Роговица выпуклая. Хрусталик имеет форму двояковыпуклой линзы, диаметр которой меняется в зависимости от освещения; аккомодация происходит за счёт изменения расстояния хрусталика до сетчатки. У многих развито цветное зрение. Глаза головастиков лишены век, но при метаморфозе роговица становится более куполообразной, хрусталик уплощается, развиваются веки и связанные с ними железы и протоки. Глаза взрослых являются усовершенствованием глаз беспозвоночных и были первым шагом в развитии более продвинутых глаз позвоночных. Они обеспечивают цветовое зрение и глубину резкости. В сетчатке находятся зелёные палочки, восприимчивые к широкому диапазону длин волн[89].
Глаза бесхвостых расположены в верхней части головы и часто выдвинуты вперёд. Это обеспечивает бесхвостым широкое поле зрения; лягушка может полностью погрузиться в воду, оставив над поверхностью лишь глаза. Глаза защищены подвижными веками и дополнительно прозрачной неподвижной мембраной, предохраняющей глаза во время пребывания в воде. Цвет радужной оболочки и форма зрачка у разных видов отличаются[90].

Бесхвостые лучше видят дальние объекты, чем ближние. Квакающие лягушки немедленно умолкают при виде потенциальной угрозы и даже её тени, но чем ближе объект, тем хуже они его видят[90]. Когда лягушка выстреливает языком в сторону добычи, она реагирует на маленький движущийся объект, который плохо различим. Она прицеливается заранее, так как особенности анатомии вынуждают её закрывать глаза при вытягивании языка[91]. Вопрос о наличии у бесхвостых цветного зрения не решён. Опытами была доказана положительная реакция бесхвостых на голубой свет[92].
Лягушки обладают уникальным среди позвоночных зрительным аппаратом. В ходе исследований было обнаружено, что почти 95 % информации поступает в рефлекторный отдел мозга. Это приводит к тому, что лягушка не видит, где она находится. Основной вывод — лягушки видят только движущиеся предметы[93].
Органы обоняния функционируют только в воздушной среде, представлены парными обонятельными мешками. Их стенки выстланы обонятельным эпителием. Открываются наружу ноздрями, а в ротоглоточною полость — хоанами[89].

В органе слуха новый отдел — среднее ухо. Наружное слуховое отверстие закрывает барабанная перепонка, соединённая со слуховой косточкой — стремечком. Стремечко упирается в овальное окно, ведущее в полость внутреннего уха, передавая ему колебания барабанной перепонки. Для выравнивания давления по обе стороны барабанной перепонки полость среднего уха соединена с ротоглоточной полостью слуховой трубой. Некоторые червяги обладают электрорецепторами, которые позволяют им находить предметы вокруг себя, когда они погружены в воду. Уши хорошо развиты у лягушек. Наружного уха нет, но большая круглая барабанная перепонка лежит на поверхности головы сразу за глазом. Это вибрирует, и звук передаётся через единственную кость, стремя во внутреннее ухо. Таким образом слышны только высокочастотные звуки, такие как брачные крики. Существует участок специализированных волосковых клеток во внутреннем ухе, способный обнаруживать более низкочастотные звуки. Другой особенностью, уникальной для лягушек и саламандр, является колумелла-жаберный комплекс, примыкающий к слуховой капсуле. Уши саламандр и червяг менее развиты, чем у лягушек, поскольку они не общаются друг с другом с помощью звука[89]. Как правило, земноводные слышат как на земле, так и под водой. Внешнего уха у них нет, но, как правило[94], позади каждого глаза присутствует барабанная перепонка. Звук вызывает вибрацию перепонок, которые передают её в среднее и внутреннее ухо. Размер барабанных перепонок и дистанция между ними коррелируют с частотой звука, на которой квакает данная лягушка. У некоторых видов, например у лягушки-быка, размер перепонок относительно размера глаз указывает на половую принадлежность. У самцов перепонки больше глаз, а у самок они схожего размера. Как правило, земноводные не полагаются только на слух, и даже на резкий звук они не будут реагировать, пока не увидят его источник[95].
Органом осязания является кожа, содержащая осязательные нервные окончания. У водных представителей и головастиков имеются органы боковой линии. Органы вкуса расположены в ротовой полости. Предполагается, что лягушка воспринимает только горькое и солёное[39].
Земноводные — первая группа четвероногих, у которых развился орган Якобсона. Это парная полость, выстланная обонятельным эпителием. Возможно, он хранит молекулы ароматов, которые проникают в него через носовую полость, получая раздражители даже после того, как запах рассеялся. У представителей отряда бесхвостых, например у серой жабы, имеется отдельная полость, также выстланная обонятельным эпителием, которая соединяется с носовой полостью тонкой трубкой диаметром 18,5 мкм. Это указывает на небольшое количество пахучего вещества, которое может попасть в орган[96].
Половые органы
Все земноводные раздельнополые. У большинства земноводных оплодотворение наружное (в воде). В период размножения яичники, наполненные зрелыми яйцеклетками, заполняют у самок почти всю брюшную полость. Созревшие икринки выпадают в полость тела, попадают в воронку яйцевода и, пройдя по нему, через клоаку выводятся наружу. Самцы имеют парные семенники. Отходящие от них семявыводящие канальцы попадают в мочеточники, одновременно служащие самцам семяпроводами. Они также открываются в клоаку[70].
Работа половых желёз земноводных находится под контролем железистого гипофиза, который, в свою очередь, контролируется гипоталамусом. Эти два отдела соединены сосудами. Гипофиз, в свою очередь, влияет на половые железы через эозинофильные и базофильные клетки посредством секреции гонадотропинов. Разрушение гипофиза связано с потерей половых органов, а у самок ещё и с исчезновением вторичных половых признаков[97].
Семенники, или мужские гонады, осуществляют гаметогенез у самцов. Они описаны как имеющие простую яйцевидную структуру. Это относится к лягушкам и большинству представителей отряда хвостатых. Имеются исключения: у Desmognathinae и некоторых лягушек неотропической области они несколько шире и длиннее, как и у Gymnophion. У последних количество долей яичка не меняется в течение жизни земноводного, тогда как у вышеупомянутых хвостатых число долей может увеличиваться со временем[97].
Семенники содержат созревающие зародышевые клетки на разных стадиях развития[97]. Как правило, самец не имеет копулятивного органа[98]. Точно так же женские гонады — яичники — проводят оогенез. Он сходен у бесхвостых амфибий, хвостатых земноводных и червяг, хотя есть и различия (например, у Ascaphus truei встречаются ооциты с 8-клеточными ядрами, у саламандр встречаются и многоядерные ооциты). Яичники содержат фолликулы, внутри которых находятся созревающие и мейотически делящиеся ооциты[97].
Жизненный цикл

В жизненном цикле земноводных чётко выделяются четыре стадии развития: яйцо (икринка), личинка (головастик), период метаморфоза, взрослая особь[99].
Большинство амфибий проходят через метаморфоз — процесс значительных морфологических изменений после рождения. При типичном развитии земноводных яйца откладываются в воду, а личинки приспосабливаются к водному образу жизни. Лягушки, жабы и саламандры вылупляются из яйца в виде личинок с наружными жабрами. Метаморфоз у земноводных регулируется концентрацией в крови тироксина, стимулирующего метаморфоз, и пролактина, противодействующего действию тироксина[100]. Конкретные события зависят от пороговых значений для различных тканей. Поскольку большая часть эмбрионального развития происходит вне родительского тела, оно подвержено многим адаптациям из-за конкретных обстоятельств окружающей среды. По этой причине головастики могут иметь роговые гребни вместо зубов, усикоподобные отростки кожи или плавники. Они также используют сенсорный орган боковой линии, подобный органу рыб. После метаморфоза эти органы становятся излишними и будут реабсорбироваться в результате контролируемой гибели клеток, называемой апоптозом. Разнообразие приспособлений к конкретным условиям окружающей среды у амфибий велико, и многие открытия ещё не сделаны[99].
Икра

Земноводные относятся к анамниям. Их яйца лишены зародышевых оболочек, в связи с чем для развития им требуются постоянное увлажнение[101].

Подавляющее большинство земноводных откладывают икру в пресных водоёмах, однако известны и исключения: червяги откладывают яйца в почву и обвивают место закладки, тем самым увлажняя яйца собственной слизью, амфиума, гигантские саламандры, аллегамские скрытожаберники и некоторые другие амфибии делают кладку на суше. Даже в этих случаях яйца нуждаются в повышенной влажности окружающей среды, обеспечение которой ложится на родителя. Известны виды, которые носят икринки на своём теле: самка сетчатой веслоногой лягушки прикрепляет их к животу, а самцы жаб-повитух обматывают шнурообразную кладку вокруг задних ног. Особенно необычно выглядит забота о потомстве у суринамской пипы — оплодотворённая икра вдавливается самцом в спину самки и последняя носит её на себе, пока из икры не вылупятся молодые пипы. В яйце зародыш подвешен в перивителлиновой жидкости и окружён полупроницаемыми студенистыми капсулами, а желточная масса обеспечивает питательные вещества. Когда личинки вылупляются, капсулы растворяются ферментами, выделяемыми железой на кончике рыла. Яйца некоторых саламандр и лягушек содержат одноклеточные зелёные водоросли. Они проникают в желейную оболочку после откладывания яиц и могут увеличить снабжение эмбриона кислородом посредством фотосинтеза. Похоже, что они ускоряют развитие личинок и снижают смертность. Яйца могут откладываться по одному, несколько или длинными нитями. Места для откладывания яиц: вода, грязь, норы, мусор и растения, а также некоторые амфибии откладывают икру под брёвнами или камнями[70][89].
Размер и форма агломерата икры характерна для каждого вида. Лягушки семейства Ranidae имеют тенденцию к шарообразным кластерам, а жабы к длинным цилиндрическим кластерам. Крошечный кубинский свистун откладывает икринки по одной и зарывает их во влажную почву. Leptodactylus pentadactylus создаёт пенное гнездо в норе, откладывая в него около тысячи икринок. Головастики появляются на свет, когда вода заполняет нору, а иногда развитие полностью происходит в гнезде. Красноглазая квакша откладывает икринки на листья, расположенные над поверхностью водоёма. Вылупляясь, головастики падают с листьев в воду. У некоторых видов на определённой стадии развития зародыши в икринках могут уловить вибрации, вызываемые хищниками (осами, змеями), и вылупиться раньше времени, чтобы приобрести мобильность и избежать гибели[102]. В общем, длительность стадии развития зародышей в икре зависит от конкретного вида и окружающих условий. Как правило, головастики вылупливаются в течение недели после того, как капсула икринки распадается под воздействием гормона, вырабатываемого зародышем[9].

Личинки

Из икринок вылупляются личинки (у бесхвостых земноводных называемые головастиками), ведущие водный образ жизни. По своему строению личинки напоминают рыб: у них отсутствуют парные конечности, дышат жабрами (наружными, затем внутренними) и кожей; имеют двухкамерное сердце и один круг кровообращения, органы боковой линии. Некоторые червяги, альпийские саламандры и некоторые африканские живородящие жабы являются живородящими. Их личинки питаются железистым секретом и развиваются в яйцеводе самки, часто в течение длительного времени. Другие земноводные, но не червяги, яйцеживородящие. Яйца сохраняются в теле родителей или на нём, но личинки питаются желтками своих яиц и не получают питания от взрослых особей. Личинки появляются на разных стадиях своего роста, до или после метаморфоза, в зависимости от их вида[103].

Бесхвостые земноводные
Головастики лягушек, в отличие от других амфибий, не похожи на взрослых особей[104]. Личинки бесхвостых, появляющиеся из икринок, известны как «головастики». Они ведут полностью водный образ жизни, но известно одно исключение — головастики вида Nannophrys ceylonensis полусухопутные и обитают среди мокрых камней[105][106]. Их тело, как правило, имеет овальную форму, хвост длинный, сплющенный по вертикали, приспособлен для плаванья. У головастиков хрящевой скелет, глаза лишены век, есть боковая линия, для дыхания служат жабры[107]. В начале у головастиков появляются внешние жабры, а позже внутренние (жаберный мешок закрывает жабры и передние ноги). Развивающиеся лёгкие служат дополнительным дыхательным органом. Некоторые виды проходят метаморфоз ещё в икринке, и из икринок вылупляются лягушата. У головастиков нет настоящих зубов, но у многих видов челюсти покрыты параллельными рядами кератиновых зубчиков (два ряда на верхней челюсти, три ряда на нижней и роговой клюв). Количество рядов и точная морфология рта варьируют у разных видов и могут служить диагностическим признаком. Головастики семейства пиповые (за исключением рода Hymenochirus) имеют пару передних усиков, делающих их похожими на небольших сомиков. Головастики имеют хрящевой скелет, жабры для дыхания (сначала внешние жабры, позже внутренние), систему боковых линий и большие хвосты, которые они используют для плавания[108]. У недавно вылупившихся головастиков вскоре появляются жаберные мешки, закрывающие жабры. Лёгкие развиваются рано и используются как вспомогательные органы дыхания, головастики поднимаются к поверхности воды, чтобы глотать воздух. Некоторые виды завершают своё развитие внутри яйца и вылупляются прямо в маленьких лягушек. У этих личинок нет жабр, но есть специальные участки кожи, через которые происходит дыхание. Хотя у головастиков нет настоящих зубов, у большинства видов челюсти имеют длинные параллельные ряды небольших ороговевших структур, называемых керадонтами, окружённых роговым клювом. Передние ноги формируются под жаберным мешком, а задние становятся видными через несколько дней[9]. Головастики, как правило, травоядны и питаются водорослями, отфильтрованными из воды через жабры. Некоторые виды являются хищниками уже на стадии головастика и питаются насекомыми; головастики (Osteopilus septentrionalis практикуют каннибализм), а также поедают мелких рыб. Головастики, рано отрастившие ноги, могут стать жертвой своих собратьев[109].
На головастиков охотятся рыбы, саламандры, хищные жуки и птицы (например, зимородок). Некоторые головастики, в том числе личинки Bufo marinus, ядовиты. У разных видов бесхвостых стадия головастика продолжается от недели до нескольких месяцев и зависит от стратегии размножения[9].
После завершения стадии головастика бесхвостые проходят процесс метаморфоза, во время которого системы организма резко перестраиваются во взрослую форму. При метаморфозе происходят быстрые изменения в организме, так как полностью меняется образ жизни лягушки. Как правило, метаморфоз длится около суток. Он начинается с выработки гормона тироксина, который влияет на развитие тканей. Так, изменение органов дыхания включает в себя развитие лёгких параллельно с исчезновением жабр и жаберного мешка. Передние конечности становятся видимыми. Нижняя челюсть приобретает характерную для хищника форму, кишечник укорачивается. Нервная система адаптируется под стереоскопическое зрение и слух, а также под новые способы передвижения и питания. Глаза сдвигаются выше, формируются веки и связанные с ними железы. Модифицируются органы слуха (появляется слуховая перепонка и среднее ухо). Кожа становится толще и крепче, боковая линия исчезает (у большинства видов), формируются кожные железы. На последнем этапе метаморфоза исчезает хвост, ткани которого идут на развитие конечностей[110][111].Спиралевидный рот с роговыми зубными гребнями резорбируется вместе со спиральной кишкой. У животного развивается большая челюсть, и его жабры исчезают вместе с жаберным мешком. Быстро растут глаза и ноги, формируется язык. Есть связанные изменения в нейронных сетях, такие как развитие стереоскопического зрения и потеря системы боковой линии. Через несколько дней хвост реабсорбируется из-за более высокой концентрации тироксина, необходимой для этого[112][113].

-
Личинка лягушки Rana temporaria за день до метаморфоза
-
Посреди метаморфоза — челюсти трансформированы, глаза увеличены, видны остатки жаберного мешка
-
Лягушонок с остатками хвоста, метаморфоз почти завершён
Хвостатые амфибии
Типичная личинка хвостатых земноводных, когда вылупляется из икры, больше похожа на взрослую особь, чем у бесхвостых. Перистые наружные жабры прикреплены к хрящевым жаберным дугам. Имеются широкие спинные или хвостовые плавники. Глаза лишены век. На нижней челюсти и на верхней челюсти имеются зубы, три пары перистых наружных жабр, слегка уплощённое тело и длинный хвост со спинным и брюшным плавниками. Передние лапы могут быть частично развиты, а задние в зачаточном состоянии у видов, обитающих в прудах, и могут быть немного лучше развиты у видов, размножающихся в проточных водах. У головастиков, живущих в прудах, часто есть пара стабилизаторов, стержнеобразных структур по обеим сторонам головы, которые не дают жабрам соприкасаться с отложениями. Некоторые представители родов Ambystoma или Dicamptodon производят личинок, которые никогда полностью не созревают, в зависимости от вида и популяции. Они могут постоянно оставаться в личиночном состоянии. Это явление называется неотенией[70][114].
Описание

У тритонов и саламандр метаморфозы менее интересны, чем у лягушек. Это связано с тем, что личинки уже плотоядны и продолжают питаться как хищники, когда становятся взрослыми, поэтому их пищеварительная система не изменяется. Их лёгкие начинают функционировать рано, работают они довольно плохо, но головастики не дышат ими так активно, как головастики лягушек. Другие метаморфозы, это уменьшение размера или потерю хвостовых плавников, закрытие жаберных щелей, утолщение кожи, развитие век и определённые изменения в зубном ряду и строении языка. Наибольшую уязвимость при трансформации проявляют хвостатые земноводные, так как развиваемая ими скорость плавания значительно падает, а длинный хвост, медленно проходящий различные метаморфозы является препятствием на суше[115]. Трансформация может произойти примерно через 3 месяца[97]. Жабры никогда не закрываются, они рассасываются непосредственно перед выходом из воды. Другие изменения включают уменьшение размера или потерю спинного плавника, закрытие жаберных щелей, утолщение и укрепление кожи, развитие век и некоторые изменения в зубном ряду и строении языка. Взрослые хвостатые весной и летом возвращаются в воду, а зимой живут на суше. Для адаптации к воде необходим гормон пролактин, а адаптация к наземным условиям зависит от тироксина[114]. Наружные жабры, рассосавшиеся до первого выхода на сушу, после возвращения в воду не восстанавливаются[116].

При вылуплении типичная личинка саламандры имеет глаза без век, зубы как в верхней, так и в нижней челюсти, три пары перистых наружных жабр и длинный хвост со спинным и брюшным плавниками. Передние конечности могут быть частично развиты, а задние конечности могут быть рудиментарными у видов, живущих в пруду, но могут быть более развиты у видов, которые размножаются в движущейся воде. Личинки прудового типа часто имеют пару балансиров, стержнеобразных структур по обе стороны головы, которые могут предотвратить засорение жабр отложениями[117]. Оба они способны размножаться[117]. Саламандры без лёгких из семейства Plethodontidae ведут наземный образ жизни и откладывают небольшое количество непигментированных яиц скоплением среди влажной опавшей листвы. Каждое яйцо имеет большой желточный мешок, и личинка питается им, пока развивается внутри яйца, полностью сформировавшись в молодую саламандру. Самка саламандры часто высиживает яйца. Было замечено, что у представителей рода Ensatinas самка обвивается вокруг них и прижимается к ним областью горла, массируя их слизистым секретом[9].
Неотения
У некоторых есть личинки, которые никогда полностью не развиваются во взрослую форму, это состояние, известное как неотения, присутствует, например, у аксолотля. Неотения возникает, когда скорость роста животного очень низкая, и обычно связана с неблагоприятными условиями, такими как низкая температура воды, которая может изменить реакцию тканей на гормон тироксин, а также нехватка еды. Существует пятнадцать видов неотенических саламандр, в том числе виды американских протеев (Necturus), европейский протей (Proteus) и угревидная амфиума (Amphiuma), а также множество других видов, таких как северо-западная саламандра (Ambystoma gracile) и тигровая саламандра (A. tigrinum), которые применяют эту стратегию при соответствующих условиях окружающей среды и других обстоятельствах[118][119]. Они также могут трансформироваться и во взрослое животное. В обоих стадиях животные готовы и способны к размножению. Неотения возникает при очень низкой скорости роста, обычно связанной с неблагоприятными условиями, такими как низкая температура воды, которая может изменить реакцию ткани на гормон тироксин. Другие факторы, которые могут препятствовать метаморфозу, включают нехватку пищи, недостаток микроэлементов и внутривидовую конкуренцию. Амбистома тигровая (Ambystoma tigrinum) также иногда проявляет неотению, в этой форме она может достигать действительно больших размеров. Зрелая особь ведёт наземный образ жизни, а личинка обитает в воде, приобретая способность к размножению (сохраняя личиночное состояние)[120].
Безногие земноводные


Развитие личинок цейлонский рыбозмей из Шри-Ланки хорошо изучено. Личинки, похожие на угрей, вылупляются из яиц и направляются в воду. У них три пары наружных красных перистых жабр, голова с двумя рудиментарными глазами и короткий хвост с плавниками.В основном они активны ночью, вскоре теряют жабры и совершают вылазки на сушу. Метаморфозы постепенные. К десятимесячному возрасту у них развилась заострённая голова с сенсорными щупальцами возле рта, и они потеряли глаза, системы боковых линий и хвосты. Кожа утолщается, тело делится на сегменты. К этому времени они уже вырыли себе нору и живут на суше[121].
Большинство видов червяг живородящи. Типичным из них является Typhlonectes Compressicauda, вид из Южной Америки. Одновременно в яйцеводе может развиваться до девяти личинок. Они довольно длинные, имеют парные мешкообразные жабры, маленькие глаза и специализированные зубы-скребки. Сначала они питаются желтками яиц, но по мере того, как этот источник питания иссякает, они начинают грызть реснитчатые эпителиальные клетки, выстилающие яйцеводы. Это стимулирует секрецию жидкости, богатой липидами и мукопротеинами, которыми они питаются вместе с соскобами со стенки яйцеводов. Они могут увеличить свою длину в шесть раз и быть в два раза длиннее своей матери до рождения. К этому времени они претерпели метаморфоз, потеряли глаза и жабры, у них развилась более толстая кожа и ротовые щупальца, а зубы снова исчезли и рассосались. Постоянный набор зубов вырастает вскоре после рождения[122].
Кольчатая червяга (Siphonops annulatus) выработала уникальное приспособление для целей размножения. Потомство питается слоем кожи, специально выращенным взрослыми в результате явления, известного как материнская дерматофагия. Выводок питается партиями в течение примерно семи минут с интервалом примерно в три дня, что даёт коже возможность восстановиться. Между тем, было замечено, что они проглатывают жидкость, выделяемую из материнской клоаки[123].


Взрослые особи
Процесс метаморфоза у бесхвостых амфибий происходит довольно быстро, тогда как у более примитивных саламандр и безногих земноводных он сильно растянут во времени[124].
Бесхвостые, прошедшие метаморфоз, расселяются в характерной для своего вида среде обитания. Практически все виды взрослых бесхвостых хищные. Они охотятся на беспозвоночных, включая членистоногих, червей и улиток. Существуют крупные виды, которые поедают других земноводных, небольших млекопитающих и птиц. Одни бесхвостые ловят свою быстро двигающуюся добычу клейким языком, другие запихивают пищу в рот передними конечностями. Древесная лягушка Xenohyla truncata является исключением, поскольку она включает в свой рацион фрукты[125]. На бесхвостых охотятся многие хищники, в том числе цапли, ястребы, рыбы, крупные саламандры, змеи, еноты, скунсы, хорьки и другие[126].
Земноводные являются первичными хищниками, важной составляющей пищевой цепи. Будучи холоднокровными животными, они эффективно используют потребляемую пищу, затрачивая лишь небольшую часть энергии на метаболические процессы и конвертируя остальное в биомассу. Они служат пищей вторичным хищникам, а сами питаются наземными членистоногими, в основном травоядными. Таким образом, поедая потребителей растений, амфибии увеличивают прирост биомассы растений, что способствует балансу экосистемы[127].
Продолжительность жизни бесхвостых в естественных условиях мало изучена. С использованием методов скелетохронологии продолжительность жизни лягушки Rana muscosa была измерена по сезонным изменениям роста фаланг пальцев. Полученные данные позволяют предположить, что максимальная продолжительность жизни взрослой особи составляет 10 лет, а учитывая стадию головастика, которая у этого вида длится около 4 лет, срок жизни этих лягушек равен 14 годам[128]. В неволе зарегистрирована продолжительность жизни бесхвостых до 40 лет, этого возраста достигла обыкновенная жаба. Жаба-ага жила в неволе 24 года, а лягушка-бык — 14 лет[129]. Домашние африканские роющие лягушки могут прожить в неволе до 35 лет[130].
Саламандры могут жить до 43 лет (огненная, китайская и японская исполинские саламандры)[1].
Забота о потомстве
Забота о потомстве у амфибий мало изучена, но, как правило, чем больше количество яиц в кладке, тем меньше вероятность проявления какой-либо степени родительской заботы. У 20 % видов амфибий одна или обе взрослые особи играют определённую роль в заботе о потомстве[131]. Те виды, которые размножаются в небольших водоёмах или других специализированных местообитаниях, как правило, заботятся о потомстве и методы помощи у них достаточно интересны[132].

Многие лесные саламандры откладывают яйца под брёвна или камни на суше. Чёрная горная саламандра вынашивает яйца и охраняет их от хищников, пока эмбрионы питаются желтками своих яиц. Когда они полностью разовьются, они вырываются из икры, будучи уже полностью сформированными саламандрами. Самцы некоторых видов примитивных саламандр, выкапывают подводное гнездо, где самки откладывают икру. Затем самец охраняет это место в течение двух или трёх месяцев до вылупления яиц[133].

Южноамериканская лягушка Engystomops pustulosus строит из пены гнездо, в которое она откладывает икру. Пеноматериал состоит из белков и лектинов и, возможно, имеет антибактериальные свойства[134]. Несколько пар лягушек могут строить совместное гнездо. В этом случае вначале строится «плот», а затем лягушки откладывают икру в его центре, чередуя откладывание икры и формирование пеноматериала, завершая процесс созданием пенного слоя поверх икры[135]. Самцы лягушек из семейства филломедуз строят чаши из глины высотой 10, а шириной 30 сантиметров, куда самки откладывают икру. Головастики живут в посудине до превращения в лягушку; так они более защищены от хищников[1].

Самец крохотного вида Colostethus subpunctatus защищает скопление яиц, спрятанное под камнем или бревном. После вылупления икры самец переносит на спине головастиков. Самец жабы-повитухи наматывает яичные нити вокруг своих бёдер и носит яйца в течение восьми недель. Он держит их влажными, а когда они готовы вылупиться, посещает пруд или канаву и выпускает головастиков[136]. Сумчатая лягушка откладывает яйца на землю. Когда они вылупляются, самец носит головастиков в выводковых сумках на задних лапах. Самка заботливой лягушки (Rheobatrachus spp) выращивала личинок в своём желудке после проглатывания яиц. Головастики выделяют гормон, который подавляет пищеварение у матери, пока они развиваются, потребляя очень большой запас желтка. Когда развитие лягушат заканчивалось, самка отрыгивала их наружу[137][138][139]. Суринамская пипа выращивает своих детёнышей в порах на спине, где они остаются до метаморфоза[140]. Сумчатая квакша после спаривания откладывает яйца, а самец помогает ей закинуть их на спину, где находится выводковая сумка. Через некоторое время из щели появляется 20—200 молодых лягушат. Ринодерма Дарвина — крохотная лягушка размером 3 см; самки откладывают яйца, в то же время самцы проглатывают их в резонатор под языком. Головастики растут несколько месяцев в резонаторах и вылазят через рот уже молодыми лягушатами[1]. Поведение зернистой ядовитой лягушки Oophaga granulifera типично для целого ряда древесных лягушек семейства ядовитых древолазов Dendrobatidae. Её яйца откладываются на лесной подстилке, и когда они вылупляются, головастики переносятся один за другим на спине взрослой особи в подходящую заполненную водой щель, такую как свёрнутый лист или середина складок веток бромелии. Самка регулярно посещает «питомники» и откладывает неоплодотворённые яйца в воду, которые поедаются головастиками[141].
Образ жизни
Большинство земноводных проводит жизнь во влажных местах, чередуя пребывание на суше и в воде, однако есть некоторые чисто водные виды, а также виды, проводящие жизнь исключительно на деревьях. Недостаточная приспособленность земноводных к обитанию в наземной среде обусловливает резкие изменения их образа жизни в связи с сезонными изменениями условий существования. Земноводные способны впадать в длительную спячку при неблагоприятных условиях (холода, засуха и т. п.). У некоторых видов активность может меняться с ночной на дневную при понижении температуры ночью. Земноводные активны только в тёплых условиях. При температуре +7 — +8 °C большинство видов впадают в оцепенение, а при −2 °C — погибают. Но некоторые земноводные способны переносить длительное замораживание, пересыхание, а также регенерировать значительные утраченные части тела[118].
На суше земноводные ограничены влажными местами обитания из-за необходимости поддерживать кожу влажной[70]. Некоторые земноводные, например жаба-ага Bufo marinus и крабоядная лягушка, Fejervarya cancrivor могут жить в солёной воде мангровых болот или, как саламандра Андерсона, в солоноватых и солёных озёрах[142]. Однако жизнь большинства амфибий связана с пресной водой. Поэтому они отсутствуют на большинстве океанических островов, где условия для них в принципе благоприятны, но добраться до которых они самостоятельно не могут[143].
Питание


За некоторыми исключениями, взрослые современные земноводные во взрослой стадии — хищники, питающиеся практически всем, что движется, что они могут проглотить. Рацион в основном состоит из мелкой добычи, которая не двигается слишком быстро, такой как жуки, гусеницы, дождевые черви и пауки. Питаются амфибии мелкими животными (в основном насекомыми и беспозвоночными), склонны к каннибализму. Растительноядных животных среди земноводных практически нет из-за крайне вялого обмена веществ. В рацион крупных водных видов может входить молодь рыб, а наиболее крупные могут охотиться на птенцов водоплавающих птиц и попавших в воду мелких грызунов[144]. Сирены часто заглатывают водные растения вместе с беспозвоночными, которыми они питаются, а бразильская древесная лягушка (Xenohyla truncata) ест большое количество фруктов[145][146]. Мексиканская роющая жаба (Rhinophrynus dorsalis) имеет длинный язык для лова муравьёв и термитов. Она выбрасывает его кончиком вперёд, в то время как другие лягушки сначала выбрасывают заднюю часть языка[147]. Крупные бесхвостые земноводные (жаба обыкновенная, жаба ага, лягушка голиаф, роющая лягушка и лягушка бык) могут выбрасывать язык на 10 см в длину[1].
Пищу в основном выбирают на глаз, даже в условиях тусклого освещения. Движение жертвы вызывает атаку. Жабы, саламандры и червяги могут ориентироваться и на запах, чтобы обнаружить добычу. Эта реакция в основном вторична, потому что было замечено, что саламандры остаются неподвижными рядом с пахнущей добычей, а питаются только в том случае, если она движется. Пещерные амфибии обычно охотятся по запаху. Некоторые саламандры, кажется, научились распознавать неподвижную добычу, когда она не имеет запаха, даже в полной темноте[9][147][148].

Земноводные обычно глотают пищу целиком, но могут сначала слегка её пережёвывать. Они, как правило, имеют маленькие зубки на нёбе, это особенность, уникальная для амфибий. Их основание и коронка состоят из дентина, разделённого некальцинированным слоем, и они сменяются через определённые промежутки времени. Саламандры, червяги и некоторые лягушки имеют один или два ряда зубов в обеих челюстях, но у большинства лягушек отсутствуют зубы в нижней челюсти, а у жаб зубы вообще отсутствуют[51].
Тигровая саламандра, или тигровая амбистома (Ambystoma tigrinum) прячется под укрытием, устраивая засаду на неосторожных беспозвоночных. Другие амфибии, напротив, активно ищут добычу, в то время как аргентинская рогатая лягушка (Ceratophrys ornata) подманивает добычу ближе, поднимая задние лапы над спиной и вибрируя жёлтыми пальцами. Червяги ловят свою добычу, хватая её слегка направленными назад зубами. Борьба добычи и дальнейшие движения челюстей загоняют её внутрь, и червяк обычно отступает в свою нору. Пищу проглатывают целиком[149][150][151].
Личинки лягушек питаются желтком яйца. Когда он заканчивается, некоторые переходят на кормление бактериями, водорослевыми корками, детритом и стружкой с подводных растений. Вода втягивается через рот, который обычно находится в нижней части головы, и проходит через жаберные пищевые ловушки между ртом и жабрами, где мелкие частицы задерживаются в слизи и отфильтровываются. У других есть специализированный ротовой аппарат, состоящий из рогового клюва, окаймлённого несколькими рядами губных зубов. Они соскребают и кусают пищу многих видов, а также взбалтывают донный осадок, отфильтровывая более крупные частицы с помощью сосочков вокруг рта. У некоторых, таких как лопатоногая жаба, сильные кусачие челюсти, они плотоядны или даже каннибалы[9][152].

Характер питания личинок хвостатых земноводных практически аналогичен питанию взрослых животных. Личинки бесхвостых имеют кардинальное отличие, питаясь растительной пищей и детритом, переходя к хищничеству лишь к концу личиночной стадии[153][154].
Размножение
Для размножения большинству земноводных требуется пресная вода, хотя некоторые откладывают яйца на суше. Некоторые могут обитать в солоноватой воде (например, крабоядная лягушка), но морских амфибий нет. Однако несколько сотен видов лягушек, обычно обитателей тёплых областей, (например, Eleutherodactylus, Pacific Platymantis, живородящие жабы Nectophrynoides и многие другие тропические лягушки) не нуждаются в воде для размножения в дикой природе. Они размножаются живорождением, экологической и эволюционной адаптации, которая позволила им стать полностью независимыми от стоячей воды. Почти все эти лягушки живут во влажных тропических лесах, и из их икринок вылупляются уже взрослые лягушата, проходя через стадию головастика внутри яйца. Репродуктивный успех многих амфибий зависит не только от количества осадков, но и от времени года[155].


В тропиках многие земноводные размножаются непрерывно или в любое время года. В регионах с умеренным климатом размножение в основном сезонное, обычно весной, и вызвано увеличением продолжительности дня, повышением температуры или дождём. Эксперименты показали важность температуры при размножении амфибий[9].
У червяг оплодотворение внутреннее, самец выдавливает сперму в клоаку самки. Парные мюллеровы железы внутри мужской клоаки выделяют жидкость, напоминающую жидкость, вырабатываемую предстательной железой млекопитающих, которая может транспортировать и питать сперму. Оплодотворение, вероятно, происходит в яйцеводе[118].
Большинство саламандр также размножаются внутренним оплодотворением. Самец проталкивает сперматозоиды в клоаку самки[118]. В большинстве случаев самец откладывает сперматофор, небольшую капсулу спермы поверх желеобразного конуса, на субстрат либо на суше, либо в воде. Самка берёт пакет со спермой, захватывая его губами клоаки и проталкивая в отверстие. Сперматозоиды перемещаются в сперматеку на клоаку, где остаются до овуляции, которая может наступить через много месяцев. Ритуалы ухаживания и методы передачи сперматофора различаются у разных видов. У некоторых сперматофор может быть помещён непосредственно в клоаку самки, в то время как у других самка может направляться к сперматофору или удерживаться объятиями, называемыми амплексусом. Некоторые примитивные саламандры из семейств Sirenidae, Hynobiidae и Cryptobranchidae размножаются внешним оплодотворением так же, как и лягушки: самка откладывает яйца в воду, а самец выделяет сперму на яйцеклетку[118].
За некоторыми исключениями, лягушки размножаются внешним оплодотворением. Как правило, самцы обычно прибывают первыми к месту размножения, призывают кваканьем самок. Другие самцы спокойно остаются поблизости, ожидая возможности отобрать самку. Самки выбирают партнёра и откладываются яйца. Самец крепко обхватывает самку передними конечностями либо за передними, либо перед задними лапами, или вокруг шеи. Они остаются в амплексусе, их клоаки расположены близко друг к другу. Самка откладывает яйца, а самец покрывает их спермой. Шероховатые подушечки на лапках самца помогают удерживать хватку. Часто самец собирает и удерживает яичную массу, образуя задними лапами подобие корзины. Хвостатая лягушка размножается внутренним оплодотворением. «Хвост» есть только у самца и используется для оплодотворения самки. Эта лягушка живёт в ручьях с быстрым течением, и внутреннее оплодотворение сохраняет сперму, не унося её водой[118].
Передвижение
Большинство хвостатых амфибий ползают, волоча своё тело по земле. В воде они плавают, шевеля хвостом и телом, чем похожи на крокодила. Безногие земноводные передвигаются, как змеи или черви, волоча тело по земле, двигая им. Плоский и широкий череп сочленяется с позвоночником при помощи 2 мыщелков, образованных затылочными костями. У большинства земноводных четыре пальца на передней лапе и пять на задней, но ни на одной из них нет когтей (только у некоторых саламандр и волосатой лягушки). У некоторых саламандр меньше пальцев. Безногие амфибии передвигаются на манер дождевых червей с перемещающимися вдоль тела зонами мышечных сокращений. На поверхности земли или в воде они передвигаются, покачивая телом из стороны в сторону[9]. Лапы имеют приспособления к образу жизни: перепонки между пальцами для плавания, широкие клейкие подушечки на пальцах для лазания и ороговевшие бугорки на задних лапах для рытья (лягушки обычно копают землю назад). У большинства саламандр конечности короткие. Передвижение по суше осуществляется ходьбой, а хвост часто качается из стороны в сторону или используется в качестве опоры, особенно при лазании. При их обычной походке выдвигается вперёд только одна нога, как это было принято у их предков, лопастных рыб[70]. Некоторые саламандры (многие виды рода лазающие саламандры) лазают по деревьям и имеют длинные конечности, большие пальцы ног и цепкие хвосты[116]. У водных саламандр и головастиков лягушек хвост имеет спинной и брюшной плавники и перемещается из стороны в сторону как средство движения. У взрослых лягушек нет хвостов, а у червяг они есть, однако они очень короткие[9]. У бесхвостых же земноводных способов передвижения существенно больше[1].
Бесхвостые передвигаются различными способами. В зависимости от среды обитания они прыгают, бегают, ходят шагом, плавают, роют норы, лазают по деревьям или планируют.

Бесхвостые считаются лучшими прыгунами из всех позвоночных (по длине прыжка относительно размеров тела)[156]. Ускорение в прыжке может достигать 20 м/с2. Виды бесхвостых сильно отличаются друг от друга по своим способностям к прыжкам. Внутри вида существует положительная корреляция между размером особи и длиной прыжка, но относительная длина прыжка (длина прыжка, поделённая на длину тела) при этом уменьшается. Индийская лягушка Euphlyctis cyanophlyctis имеет уникальную способность выпрыгивать из воды из позиции лёжа на поверхности[157]. Крошечные лягушки Acris crepitans могут «перебегать» по поверхности пруда короткими резкими прыжками[158].
Способность к прыжкам у бесхвостых обусловлена тем, что большая часть их опорно-двигательного аппарата модифицирована для прыжков. Голень, фибула и ступни слиты в единую, прочную кость, равно как и лучевая и локтевая кости передних конечностях (они гасят инерцию во время приземления). Плюсны вытянуты, увеличивая длину ноги, что позволяет лягушке отталкиваться от земли в течение более длительного времени, увеличивая ускорение. Подвздошная кость также вытянута и формирует с крестцом подвижный сустав, который у эволюционно продвинутых бесхвостых, таких как Ranidae и Hylidae, функционирует подобно дополнительному суставу конечности, увеличивая силу прыжка. Во время прыжка передние конечности прижаты к груди, а задние вытянуты во всю длину[159]. У некоторых видов бесхвостых максимальное усилие, прикладываемое мышцами во время прыжка, может превышать их теоретическую мощность[160][161].


Бесхвостые из семейств Bufonidae, Rhinophrynidae и Microhylidae имеют короткие задние конечности и передвигаются шагом, а не прыжками[162]. Быстрое передвижение у представителей этих семейств обеспечивают либо ускоренные движения конечностей (быстрая ходьба), либо быстрые короткие прыжки. Метод передвижения Gastrophryne olivacea описан как «комбинация из бега и коротких прыжков (всего несколько сантиметров в длину)»[163].
Бесхвостые из семейств Bufonidae, Rhinophrynidae и Microhylidae имеют короткие задние конечности и передвигаются шагом, а не прыжками. Быстрое передвижение у представителей этих семейств обеспечивают либо ускоренные движения конечностей (быстрая ходьба), либо быстрые короткие прыжки. Метод передвижения Gastrophryne olivacea описан как «комбинация из бега и коротких прыжков (всего несколько сантиметров в длину)»[163].


Бесхвостые, обитающие в воде, адаптированы к плаванию; для строения их тела характерны сильные задние конечности и наличие плавательных межпальцевых перепонок. Перепонки увеличивают площадь поверхности ступни (наподобие ласт) и способствуют быстрому передвижению лягушек в воде. Головастики, как правило, имеют большие хвостовые плавники, придающие ускорение, направленное вперёд, когда хвост движется из стороны в сторону. В воде бесхвостые наиболее беспомощны во время метаморфоза, когда хвост уже атрофирован, а ноги ещё не полностью функциональны[162]. Некоторые бесхвостые адаптировались к жизни под землёй и, как следствие, к рытью нор. У этих видов бесхвостых, как правило, округлое туловище, короткие конечности, маленькая голова с выпученными глазами, а задние ноги адаптированы к рытью[1].
На протяжении своей эволюционной истории несколько не связанных между собой видов бесхвостых адаптировались к планирующему полёту[164]. Некоторые виды лягушек в тропических лесах специализированы для планирования с дерева на дерево или имеют возможность контролируемо прыгать с дерева на землю («парашютирование»). У них большие ступни, кончики пальцев расширены и оснащены клейкими подушечками, между пальцами есть летательные перепонки, а вдоль конечностей и области таза имеются дополнительные складки кожи. Растягивая пальцы и конечности, эти лягушки могут планировать на значительные расстояния (до 15 метров) между деревьями, изменяя по мере надобности направление движения[165][166][1].
Вокализация

Крики червяг и саламандр ограничиваются случайным тихим писком, ворчанием или шипением и мало изучены. Щёлкающий звук, который иногда издают червяги, может быть средством ориентации, как у летучих мышей, или формой общения. Большинство саламандр считаются безголосыми, но гигантская калифорнийская саламандра (Dicamptodon ensatus) имеет голосовые связки и может издавать дребезжащий или лающий звук. Некоторые виды саламандр издают тихий писк или визг при нападении[9].
Лягушки гораздо громче, особенно в период размножения, когда они используют свой голос для привлечения партнёров. Присутствие определённого вида в какой-либо местности легче определить по его характерному крику, чем по мимолётному взгляду самого животного. У большинства видов звук производится путём выброса воздуха из лёгких через голосовые связки в воздушный мешок или мешочки в горле или в углу рта. Он может раздуваться, как воздушный шар, и действовать как резонатор, помогая передавать звук в атмосферу или воду, когда животное находится под водой. Основная вокализация — это громкий, привлекающий самок крик самца. Этот призыв изменяется на более тихий к ухаживанию при приближении самки или если приближается другой самец-конкурент. Громкие звуки, в свою очередь, весьма опасны, так как могут привлечь хищников и требуют больших затрат энергии[167]. Обычно ночная кубинская древесная лягушка (Osteopilus septentrionalis) издаёт громкий сигнал, когда идёт дождь в светлое время суток[168][9][169].

Для каждого вида бесхвостых характерен свой тип кваканья. Кваканье — это звук, который производит проходящий через гортань воздух. У многих видов есть дополнительные адаптации, усиливающие издаваемый звук — горловые мешки, которые представляют собой растягивающиеся кожные мембраны, расположенные под горлом или по сторонам рта. У некоторых представителей бесхвостых (например, норниц и необатрахусов) нет горловых мешков, но тем не менее они способны издавать громкое кваканье, так как их ротовая полость имеет форму купола и достаточно большой объём, чтобы функционировать как усилитель. Кваканье некоторых видов бесхвостых слышно дальше чем за километр[170]. Виды бесхвостых, обитающие преимущественно вдоль проточной воды, часто не имеют адаптаций для усиления звука, так как шумный фон делает звуковую коммуникацию неэффективной[171]. Вместо неё эти виды используют визуальные способы общения («семафорят» друг другу)[171].
Как показывают наблюдения, основная доля коммуникации бесхвостых приходится на привлечение самок. Самцы могут квакать в одиночестве, а могут создавать хор, когда много самцов собирается в удобных для спаривания местах. Самки многих видов бесхвостых (например, Polypedates leucomystax) также квакают в ответ на призывы самцов, что, возможно, повышает локальную репродуктивную активность[172]. Самки предпочитают самцов, издающих более громкие и низкие звуки, которые указывают на здорового и крепкого самца, способного производить наилучшее потомство[173].
Отдельный класс звуков издают самцы или незаинтересованные самки, осёдланные другим самцом. Это характерный чирикающий звук, который сопровождает вибрация тела[174]. Древесные лягушки и некоторые виды наземных бесхвостых имеют в своём репертуаре звук-предупреждение о надвигающемся ливне, который они издают при сочетании некоторых климатических условий[174], а также специфический звук, отгоняющий чужих самцов с удерживаемой территории. Все эти звуки бесхвостые издают с закрытым ртом[174].
Некоторые бесхвостые в состоянии смертельной опасности издают сигнал бедствия с открытым ртом, получая высокий пронзительный звук. Как правило, его издаёт лягушка, схваченная хищником. Иногда дезориентированный этим воплем хищник выпускает лягушку, а иногда на него сбегаются другие хищники, отвлекая поймавшего жертву, что позволяет ей вырваться[174].
- Различия резонаторов у бесхвостых земноводных
-
-
-
-
-




Территориальное поведение
Мало что известно о территориальном поведении червяг, но некоторые лягушки и саламандры защищают свои участки территории. Обычно это места кормления, размножения или укрытия. Обычно такое поведение проявляют самцы, хотя у некоторых видов также участвуют самки и даже молодые особи. У некоторых из них есть особые приспособления, такие как увеличенные зубы для укусов или шипы на груди, лапах или больших пальцах. У саламандр защита территории включает в себя принятие агрессивной позы и, при необходимости, нападение на конкурента. Это может включать в себя хватку, погоню, а иногда и укусы, что иногда приводит к потере хвоста. Поведение красноспинных саламандр (Plethodon cinereus) хорошо изучено. 91 % отмеченных особей, которые позже были повторно пойманы, находились в пределах метра (ярда) от их первоначального дневного укрытия под бревном или камнем[175]. Саламандры оставляли запаховые следы вокруг своих территорий, которые в среднем составляли от 0,16 до 0,33 квадратных метра (от 1,7 до 3,6 квадратных футов), и иногда на них жили пара самцов и самок. Саламандры поднимают тело, поддерживая себя с помощью хвоста и смотрят на противника. Обычно производился резкий выпад либо в область хвоста, либо в носогубные бороздки[176][177].
У лягушек территориальное поведение самцов часто наблюдается в местах размножения; призыв — это одновременно объявление о праве собственности на часть этого ресурса и привлекающий призыв к потенциальным самкам. В целом, более глубокий голос показывает более тяжёлую и сильную особь, и этого может быть достаточно, чтобы предотвратить вторжение более мелких самцов. Самцы обычно терпимо относятся к самцам-владельцам соседних территорий, в то же время энергично нападая на неизвестных особей. Если конкуренты не испугались предупреждающего крика, могут иметь место резкие выпады и толчки в грудь. Методы борьбы включают в себя толчки и пихания, сдувание голосового мешка противника, захват его за голову, прыжки на спину, укусы, преследование, брызги и погружение его под воду[178][179].
Защитные механизмы
У земноводных мягкие тела с тонкой кожей, у них нет когтей, защитной брони или шипов. Поэтому, чтобы уберечься от хищников, многие из амфибий развили различные защитные механизмы. Первая линия защиты у саламандр и лягушек — это выделяемый ими слизистый секрет, который сохраняет кожу влажной и делает их скользкими и трудными для захвата. Секреция часто бывает липкой, неприятной или токсичной. Было замечено, что у змей происходит воспаление во рту, когда они пытаются проглотить африканских когтистых лягушек (Xenopus laevis), что даёт лягушкам возможность убежать[180]. Червяги мало изучены в этом отношении, но кайенская водная червяга (Typhlonectes compressicauda) производит токсичную слизь, убившую хищную рыбу в эксперименте по кормлению в Бразилии. У некоторых саламандр кожа ядовита[181]. Желтобрюхий тритон из Северной Америки и другие представители этого рода содержат нейротоксин тетродотоксин, почти идентичный тому, который содержится в рыбе-фугу. Обращение с тритонами не причиняет вреда, но проглатывание даже самых незначительных количеств кожи смертельно. В экспериментах было обнаружено, что рыбы, лягушки, рептилии, птицы и млекопитающие восприимчивы к яду тритонов[182]. Единственными хищниками, обладающими некоторой толерантностью к яду, являются определённые популяции обыкновенных подвязочных змей (Thamnophis sirtalis). В местах, где сосуществуют и змеи, и саламандры, змеи выработали иммунитет благодаря генетическим изменениям и потому питаются амфибиями. Коэволюция происходит с тритоном, увеличивающим свои токсические способности с той же скоростью, с которой змея развивает свой иммунитет[183]. Некоторые лягушки и жабы ядовиты, основные ядовитые железы находятся сбоку на шее и под бородавками на спине. Эти области представляются нападающему животному, и их выделения могут быть неприятными на вкус или вызывать различные физические или неврологические симптомы. Всего было выделено более 200 токсинов из ограниченного числа исследованных видов амфибий[184][9][180]

Самые ядовитые позвоночные животные на Земле принадлежат к отряду бесхвостых земноводных — это лягушки-древолазы[185]. Яд, который выделяют кожные железы земноводных, содержит убивающие бактерии вещества (бактерициды). У большинства земноводных России яд совершенно безвреден для человека. Однако многие тропические лягушки не так безопасны[1]. Абсолютным «чемпионом» по ядовитости среди всех позвоночных, включая змей, следует признать жительницу тропических лесов Колумбии — крохотного, размером всего 2—3 см, ужасного листолаза (местные жители называют его «кокои»[186]). Её кожная слизь содержит батрахотоксин. Из кожи кокои индейцы приготовляют яд для стрел. Одной лягушки достаточно, чтобы отравить 50 стрел. Два миллиграмма очищенного яда достаточно, чтобы убить человека[1][187].
Ядовитые виды часто используют яркую окраску, чтобы предупредить потенциальных хищников о своей токсичности. Эти предупреждающие цвета, как правило, красный или жёлтый в сочетании с чёрным, например, огненная саламандра (Salamandra salamandra). Как только хищник попробовал сьесть животное, он, вероятно, запомнит окраску. У некоторых видов, таких как огнебрюхая жаба (Bombina spp.), предупреждающая окраска находится на животе, и эти животные принимают оборонительную позу при нападении, демонстрируя хищнику свои яркие цвета. Лягушка Allobates zaparo не ядовита, а имитирование других токсичных видов в его местности — стратегия, которая может обмануть хищников (мимикрия)[188][189]. В случае присутствия обоих видов вместе, Allobates zaparo копирует менее токсичную[190]. Многие амфибии ведут ночной образ жизни и днём прячутся, тем самым избегая дневных хищников, охотящихся на виду. Другие амфибии используют камуфляж, чтобы не быть обнаруженными. Они окрашены в различные цвета, такие как пятнистые, коричневые, серые и оливковые, которые сливаются с местностью. Некоторые саламандры принимают оборонительные позы, когда сталкиваются с потенциальным хищником, таким как североамериканская северная короткохвостая землеройка (Blarina brevicauda). Их тела корчатся, они поднимают и хлещут хвосты, из-за чего хищнику трудно избежать контакта с их гранулярными железами, вырабатывающими яд. Некоторые саламандры при нападении на них отбрасывают свой хвост, жертвуя этой частью тела, чтобы убежать[191]. Хвост может иметь сужение у основания, чтобы его можно было легко отсоединить. Хвост регенерируется позже, но затраты энергии на его замену у животного значительны. Некоторые лягушки и жабы надуваются, чтобы казаться большими и свирепыми для змей, а некоторые лопатоногие жабы (Pelobates spp) кричат и прыгают на нападавшего. Гигантские саламандры рода Andrias, а также лягушки из родов Ceratophrine и Pyxicephalus обладают острыми зубами и способны прокусить кожу человека или млекопитающего при оборонительном укусе[192][17][193].


Некоторые виды совмещают маскировочную стратегию с апосематизмом. Так, краснобрюхая жерлянка имеет нейтральный окрас верхней части тела и яркие красные или жёлтые пятна на брюхе. В случае опасности жерлянка принимает позу, демонстрирующую яркие пятна, и отпугивает хищника[1].
Некоторые бесхвостые в таких ситуациях симулируют угрозу. Обыкновенная жаба принимает характерную стойку, раздуваясь, опуская голову и задирая зад[194]. Лягушка-бык в опасности приседает, прикрывая глаза и наклоняя голову вперёд. Эта стойка выпячивает паротоидные железы и закрывает уязвимые части её тела. Некоторые лягушки в момент опасности издают громкий пронзительный звук, который может отпугнуть хищника. Несмотря на то, что большинство хищников избегает жаб, последние входят в рацион подвязочных змей. Наблюдения за поведением недавно прошедших метаморфоз американских жаб показали, что при виде змеи они приседают и замирают. Как правило, эта стратегия оправдывает себя — змея проползает мимо, не заметив жабу[195].
Терморегуляция и активность
В связи с тем, что органы тела снабжаются смешанной кровью, у амфибий низкий уровень обмена веществ, и поэтому они холоднокровные животные. Земноводные — холоднокровные, или пойкилотермные животные, температура тела которых не поддерживается за счёт внутренних физиологических процессов, а зависит от температуры внешней среды. Их скорость метаболизма низкая, и в результате их потребности в пище и энергии ограничены[9].
Значение в природе
Земноводные встречаются на всех континентах, кроме Антарктиды, и в подавляющем большинстве наземных экосистем Земли. В некоторых типах экосистем (например, в смешанных лесах умеренной зоны Неарктики) они являются одними из самых многочисленных (относительно других животных и по биомассе) позвоночных, уступая лишь грызунам. Как хищники они оказывают значительное влияние на пищевые цепи и поток энергии в экосистемах: на Ближнем Востоке увеличение вылова амфибий для пищевых целей привело к сокращению популяции лягушек и значительному увеличению численности количество комаров, численность которых ранее ограничивалась охотящимися на них амфибиями. Многие хищники, более сильные, полагаются на земноводных как на основной источник пищи. Стройная подвязочная змея питается почти исключительно двумя видами лягушек - иосемская жаба и Rana muscosa. Сокращение их численности угрожает популяции этой змеи и других видов (включая хищных птиц). В мелких и периодических водоёмах головастики амфибий являются одними из основных детритофагов и травоядных, ими питаются различные хищные беспозвоночные (личинки и взрослые формы водяных скорпионов), жуков-плавунцов, рыбы, птицы). Было подсчитано, что только в странах СНГ 91-109 видов птиц охотятся на бесхвостых, а общее количество видов, которые питаются земноводными, оценивается в 500-560 и более[1][9][196][197].
Естественные враги, болезни и паразиты
Одним из самых опасных заболеваний земноводных является хитридиомикоз. Хитридиомикоз считается самой агрессивной и смертоносной инфекцией из когда-либо поражавших позвоночных, поскольку к нему восприимчиво большое количество видов и огромен урон, наносимый этим заболеванием. Её считают одним из факторов современного шестого массового вымирания[198]. Одной из основных причин распространения этой инфекции по всему миру является международная торговля амфибиями, как декоративными видами, так и употребляемыми в пищу. Хитридиомикоз включён в список инфекций, контролируемых Всемирной организацией по охране здоровья животных[199].

У поражённых хитридиомикозом земноводных развиваются следующие физиологические патологии: эпидермальная дисфункция вследствие гиперкератоза эпидермиса (утолщение кожи приводит к нарушению обмена веществ с внешней средой, который у амфибий в значительной степени происходит через кожу, животные не могут получать необходимые питательные вещества, выделять токсины и нормально дышать), снижается уровень натрия и калия в крови и клеточной плазме, развивается дисбаланс электролитов, нарушается электролитический транспорт через эпидермис. Размножение Batrachochytrium dendrobatidis в тканях кожи хозяина (часто оно не приводит к воспалительной реакции со стороны организма хозяина) приводит к нарушениям её нормального функционирования — у большинства видов амфибий при достижении количества зооспор грибка до 10 000 штук заболевшие животные не могут нормально дышать, нарушается увлажнение, осморегуляция и терморегуляция. В крови заболевших земноводных снижается уровень определённых электролитов, таких как натрий, магний и калий. Негативно влияют на здоровье хозяина также и продукты жизнедеятельности грибков, действующие как токсины, снижающие общий иммунитет животного, влияющие на пролиферацию лимфоцитов и вызывающие апоптоз клеток. Гибель больного животного наступает через несколько дней после заражения[200].
Для бесхвостых земноводных также опасен Ribeiroia: род паразитических плоских червей из класса трематод, отращивающий захваченному земноводному дополнительную пару (или даже больше) задних лап, что делает заражённую лягушку лёгкой добычей для птиц, которые должны стать конечным хозяином для Ribeiroia[201].

Самки комаров рода Corethrella питаются кровью бесхвостых амфибий. Жертву они находят, ориентируясь по звуковым брачным сигналам лягушек. Самцы лягушек издают сложные и простые позывные сигналы. Сложные сигналы предпочитаются, как самками комаров, так и самками лягушек. Если самцы издают простые звуки, они меньше подвергаются нападению кровососов, но и вероятность спаривания таких самцов уменьшается. Комары служат переносчиками трипаносомозов лягушек[202].
Опасны также для хвостатых и бесхвостых земноводных лягушкоедки. Лягушкоедка — это зелёная падальная муха, паразитирующая на лягушках и жабах. В период размножения летом мухи откладывают свои белые продолговатые яйца на спину или голову жаб и других амфибий. Хозяевами паразита являются: обыкновенная, камышовая, зелёная жабы, травяная лягушка, жаба-повитуха, обыкновенная чесночница, обыкновенная квакша, остромордая лягушка, съедобная лягушка и даже огненная саламандра[203]. Вылупившиеся личинки проникают через носовые отверстия в голову хозяина, где въедаются в мягкие ткани ещё живущего животного. Через несколько дней передняя часть морды и головы может полностью деформироваться и исказиться. Когда личинки добираются до мозга или других жизненно важных органов, функции организма нарушаются и амфибия погибает. В своей последней фазе личинки почти полностью съедают труп животного, включая кожу и соединительные ткани, при определённых обстоятельствах — даже хрящи и кости[204].
Специализированными хищниками на бесхвостных земноводных являются жуки и их личинки рода Epomis в составе семейства жужелиц[205].
Интеллект
Земноводные имеют способности привыкания, ассоциативного обучения как с помощью классического, так и инструментального обучения, а также способностей к различению количества[206].
В эксперименте, когда саламандрам предложили живых плодовых мушек (Drosophila virilis), они выбрали больше насекомых из 1 и 2 и из 2 и 3 особей. Лягушки могут различать небольшие количества (1 против 2, 2 против 3, но не 3 против 4) и большие количества (3 против 6, 4 против 8, но не 4 против 6) добычи[207][206].
Анабиоз

В экстремальных погодных условиях некоторые виды бесхвостых погружаются в состояние анабиоза и могут не проявлять никакой активности в течение нескольких месяцев. В холодных областях бесхвостые зимой впадают в спячку. Некоторые наземные бесхвостые (например, американская жаба) роют себе на зиму нору и спят в ней. Другие виды, менее приспособленные к рытью, прячутся в расщелинах или закапываются в сухие листья. Водные виды (например, лягушка-бык), как правило, залегают на дне водоёма, частично погружаясь в ил, но сохраняя, тем не менее, доступ к кислороду, растворённому в воде. Их метаболизм замедляется, и они выживают за счёт потребления внутренних энергетических резервов. Многие бесхвостые могут выжить после замерзания. Несмотря на то, что под их кожей и в полостях тела образуются кристаллы льда, жизненно важные органы защищены от замерзания вследствие высокой концентрации глюкозы в тканях. С виду безжизненная, замёрзшая лягушка может начать дышать и возобновить работу сердца, если её отогреть[208].

С другой стороны, роющая лопатница (Cyclorana alboguttata) во время жаркого сухого сезона в Австралии впадает в состояние эстивации (летней спячки), обходясь без пищи и воды 9—10 месяцев в году. Эта лягушка зарывается в землю и сворачивается в защитном коконе, который образует её сброшенная кожа. Исследования показали, что во время эстивации метаболизм лягушки меняется так, что КПД митохондрий увеличивается, позволяя более эффективно использовать ограниченное количество энергетических ресурсов, доступных лягушке в состоянии спячки. Пытаясь ответить на вопрос, почему этот механизм не имеет широкого распространения в царстве животных, исследователи пришли к выводу, что он полезен только холоднокровным животным, находящимся в состоянии анабиоза в течение длительного периода, чьи энергетические затраты крайне низки, поскольку у них нет необходимости постоянно генерировать тепло[209]. Другое исследование показало, что для удовлетворения минимальных энергетических требований у лягушки атрофируется большинство мышц (за исключением мышц задних конечностей)[210].
Сибирский углозуб также может переживать анабиоз: его метаболизм замедляется, и он выживает за счёт потребления внутренних энергетических резервов, а его жизненно важные органы защищены от замерзания вследствие высокой концентрации глюкозы в тканях[1].
Роющая лягушка может проводить до 10 месяцев в году в анабиозе, экономя воду и пережидая условия засухи и экстремальных температур. Она зарывается глубоко в землю, где покрывает себя слизью, выставляя наружу только ноздри и входит в состояние низкой метаболической активности и задержки воды. Как только период засухи заканчивается и идут дожди, бесхвостые земноводные выходят из анабиоза и вылезают на сушу, начиная поедать всё живое. Некоторые племена в Африке откапывают этих лягушек и пьют из них воду[211].
Земноводные и человек

Благодаря живучести земноводные часто используются в качестве лабораторных животных[212].
Люди употребляют амфибий в пищу, выращивают их как домашних животных и т. п. Они естественным образом контролируют количество животных, считающихся вредителями (насекомые, улитки)[97], а некоторые виды амфибий массово использовались для борьбы с вредителями сельскохозяйственных культур (насекомыми, грызунами)[213]. Для борьбы с вредителями посевов сахарного тростника на Карибские острова и в Австралию была завезена гигантская жаба яга (Rhinella marina). В Карибском бассейне эта кампания имела умеренный успех, но в других частях света интродукция аги вызвала значительное снижение биоразнообразия — эта прожорливая амфибия питалась не только вредителями, но и другими видами и стала досаждать и уничтожать их[214]. В связи с чувствительностью к изменениям условий обитания и наличием токсических веществ (в том числе из-за голой, проницаемой кожи, сложной, восприимчивой к нарушениям жизненного цикла) их используют как виды-индикаторы, свидетельствующие о состоянии экосистемы, а некоторые лягушки съедобны — их едят, в том числе, во Франции и на Дальнем Востоке. Лягушек и жаб также скармливают пушным зверям на фермах[97]. Многие виды из семейства Dendrobatidae (преимущественно из рода Phyllobates) используются индейцами Центральной и Южной Америки для отравления стрел, используемых для охоты. Присутствующие в них алкалоиды также являются предметом исследований в плане получения новых лекарственных средств (в том числе анестетиков)[1]. Различные виды энтеогенов (главным образом буфотенин) получают из кожи и околоушных желёз земноводных во многих районах мира, в том числе среди племён Мезоамерики и Дальнего Востока[215]. Когтистая лягушка, или же гладкая шпорцевая лягушка (Xenopus laevis) является важным модельным организмом, особенно в исследованиях эмбриогенеза и регуляции транскрипции (в том числе из-за её крупных эмбрионов, с которыми легко манипулировать, и прозрачных головастиков). Она оказала неоценимые услуги и в медицине: благодаря чувствительности к хорионическому гонадотропину особи этого вида послужили первым в истории медицины тестом на беременность (достаточно было ввести самке мочу женщины, присутствие хорионического гонадотропина стимулировало лягушка откладывает яйца через несколько часов). Аналогичным образом в качестве модельного организма используется родственный вид — Xenopus tropicalis[1]. Жабы, равнинные и горные жабы (Bombina bombina и B. variegata) используются в качестве модельных организмов при изучении процессов межвидовой гибридизации и видообразования[216]. Головастики многих видов амфибий, обитающих в тропиках и зонах умеренного климата, часто используются для изучения фенотипической изменчивости и индукции механизмов защиты от хищничества и механизмов формирования видового разнообразия[217]. Кожа самых крупных лягушек идёт на украшения, сумки и другие изделия[1].
Содержание в неволе
В качестве домашних питомцев любители земноводных часто содержат их в террариумах, акватеррариумах и аквариумах[218]. Популярны такие виды, как украшенная рогатка, голубая квакша, большинство ядовитых разноцветных из семейства древолазы, шпорцевая лягушка, лягушка-водонос, жабовидная квакша, обыкновенный тритон и гребенчатый[1]. Африканская роющая лягушка является экзотическим домашним животным во многих странах мира. Продаваемые животные обычно разводятся в неволе. Домашние африканские лягушки-быки могут прожить в неволе до 35 лет[219].
В кулинарии

Лягушачьи лапки в разных странах употребляют в пищу. Традиционный способ удовлетворения местного рынка за счёт локальных популяций лягушек стал в последние годы невозможен из-за уменьшения этих популяций. В настоящее время существует развитая международная торговля лягушачьими лапками. Основные импортёры — Франция, Бельгия, Люксембург и США, а основные экспортёры — Индонезия и Китай[220]. Годовой оборот продаж американской лягушки-быка (Rana catesbeiana), которую промышленно разводят в Китае, достигает 2,4 тысяч тонн[221]. Разведением съедобных лягушек в последнее время интересуются и другие страны, например, Белоруссия[222]. Китайскую исполинскую саламандру, а также её ближайшего родича — японскую гигантскую саламандру часто употребляют в пищу, поэтому эти животные очень редкие. Лягушку—голиафа нередко едят африканцы, забрасывая на неё сеть или выставляя ловушки[223].
В научно-исследовательской сфере
Бесхвостых широко использовали в научных экспериментах. В XVIII веке биолог Луиджи Гальвани открыл с помощью экспериментов с лягушками связь между электричеством и нервной системой[224]. В 1852 году Г. Ф. Станниус использовал сердце лягушки в эксперименте, названном его именем, который доказал, что в желудочках сердца и предсердиях клетки-пейсмекеры могут независимо генерировать разный ритм[225]. Гладкую шпорцевую лягушку широко использовали в первой половине XX века в тесте на беременность после того, как английский зоолог Ланселот Хогбен открыл тот факт, что в моче беременной женщины присутствует гормон хорионический гонадотропин, который индуцирует у этой лягушки икрометание[226]. В 1952 году Роберт Бриггс и Джозеф Кинг клонировали лягушку методом пересадки ядер соматических клеток (этим же методом позже была клонирована овечка Долли). Это был первый успешный эксперимент по клонированию позвоночных путём ядерной трансплантации[227]. Лягушек широко используют в исследованиях в области эмбриологии. Шпорцевые лягушки остались модельным организмом в биологии развития и после разработки более современных тестов на беременность, поскольку их легко содержать в лабораторных условиях, а их эмбрионы достаточно крупные для манипулирования[228]. При этом гладких шпорцевых лягушек всё чаще заменяют более мелким родственником, Xenopus tropicalis, который достигает половой зрелости в 5 месяцев (а не в год или два, как гладкая шпорцевая лягушка)[229], что ускоряет исследования, требующие нескольких поколений лягушек. Геном X. tropicalis по состоянию на 2012 год находится в процессе секвенирования[230].
Исключительное разнообразие токсинов, вырабатываемых бесхвостыми, вызвало интерес биохимиков к этой «природной аптеке». Алкалоид эпибатидин, болеутоляющее, в 200 раз более мощное, чем морфий, был обнаружен у некоторых видов рода листолазов. Из кожи бесхвостых был выделен пептид, предположительно блокирующий размножение вируса ВИЧ[231][232].

Лягушек используют на практических занятиях по диссекции в школах и университетах. Как правило, их предварительно обрабатывают пигментами для получения контраста между разными системами организма. В свете движения за права животных эту практику в последнее время заменяет виртуальная диссекция «оцифрованных» лягушек — компьютерные программы, симулирующие организм живой лягушки[233].
Производство ядов
Яд бесхвостых применяют в качестве галлюциногена. В течение долгого времени считалось, что в доколумбову эпоху жители Мезоамерики использовали для этой цели яд жабы-аги. Более поздние исследования показали, что более вероятным кандидатом на эту роль является яд жабы Bufo alvarius, включающий в себя буфотенин и 5-MeO-DMT — психоактивные вещества, которые и сегодня применяют в рекреационных целях. Типичным способом употребления является курение высушенных кожных выделений жабы[234]. В СМИ появлялись сообщения о людях, которые слизывали наркотическое вещество прямо с кожи жабы, но, возможно, это городская легенда[235].
Кроме того, яд бесхвостых издревле применяли для производства отравленных стрел и дротиков. С помощью кожных выделений ужасного листолаза южноамериканские индейцы изготавливали отравленные стрелки. Наконечник натирали о спину лягушки, стрелками стреляли из духовой трубки на охоте. Комбинация двух токсинов, присутствующих в этих выделениях (батрахотоксин и гомобатрахотоксин), столь сильна, что яда одной лягушки, предположительно, достаточно, чтобы убить 22 000 мышей[236]. Два других вида бесхвостых, золотистополосый листолаз и двухцветный листолаз, также использовали как источники яда, но его концентрация в них меньше, и для того, чтобы яд начал выделяться, их необходимо подогреть на огне[237]. Эти яды исследуют на предмет их применения в медицине[238].
Генетика

Земноводные отличаются среди других позвоночных разнообразием хромосом и геномов, а также их спецификой[239]. Кариотипы были определены по крайней мере для 1193 (14,5 %) из ≈ 8500 известных видов: 963 бесхвостых, 209 хвостатых и 21 червяг. Как правило, кариотипы амфибий характеризуются 20—26 двуплечими хромосомами. Земноводные также имеют очень большие геномы по сравнению с другими видами позвоночных. Размеры генома колеблются от 0,95 до 11,5 пг у лягушек, от 13,89 до 120,56 пг у саламандр и от 2,94 до 11,78 пг у червяг[240].
Большие размеры генома препятствуют секвенированию всего генома земноводных, хотя недавно был опубликован ряд геномов. Проект по раскрытию генома лягушки Xenopus tropicalis объёмом 1,7 ГБ был первым для земноводных в 2010 году. По сравнению с некоторыми саламандрами геном лягушки крошечный. Например, геном мексиканского аксолотля оказался размером 32 Гб, что более чем в 10 раз больше генома человека (3 Гб)[241]. Размер мейотических бивалентов у хвостатых амфибий может достигать 700 мкм, как у огненной саламандры (Salamandra salamandra) и обыкновенного тритона Lissotriton vulgaris (ранее Triturus vulgaris)[239].
В Proceedings of the National Academy of Sciences (PNAS) в 2021 году была опубликована статья, обобщающая результаты многолетнего исследования гибридизации земноводных. Авторы проанализировали зоны гибридизации 41 пары европейских амфибий и измерили проницаемость всего генома. Цель состояла в том, чтобы оценить, возникает ли репродуктивная изоляция как быстрый процесс, вызванный мутациями в нескольких ключевых генах, или скорее как медленный процесс, включающий множество случайных мутаций, разбросанных по всему геному[242].
Результаты показывают, что репродуктивная изоляция у амфибий изначально развивается за счет множественных генетических несовместимостей, распространяющихся по всему геному, а не только по нескольким ключевым генам. Когда линии молодые, они могут без проблем скрещиваться, иногда на больших географических расстояниях — более ста километров для подвида одного вида лягушек в Каталонии. Миллионы лет спустя несовместимости затрагивают больше генов, то есть постепенно разрушаясь, и обмен происходит только в нескольких километрах — как между жабами на юге Польши. Таким образом, эти открытия дают новое объяснение тому, почему виды земноводных гораздо древнее других позвоночных. Репродуктивная изоляция может развиваться медленнее у амфибий, потому что требуется время, чтобы накопить множество несовместимостей, необходимых для ограничения гибридизации[242].
Угрозы и охрана



Сокращения популяций земноводных задокументированы для большинства видов земноводных. Данные проведённых мониторингов многих видов по всему миру свидетельствуют о сокращениях или даже полном исчезновении ряда популяций. На основании этого возникла распространённая гипотеза о глобальном сокращении численности земноводных, которое отмечается с конца 1980-х годов в различных местах по всему миру, и считается одной из наиболее серьёзных угроз глобальному биоразнообразию. В 2006 году считалось, что 2035 видов земноводных находятся под угрозой исчезновения, и эта цифра, вероятно, занижена, поскольку она не включает 1427 видов, по которым не было достаточно данных для оценки их статуса[243]. Считается, что это связано с рядом причин, включая разрушение и изменение среды обитания, загрязнение почвы и воды, глобальное потепление, загрязняющие вещества, нарушающие работу эндокринной системы земноводных, разрушение озоного слоя (показано, что ультрафиолетовое излучение особенно вредно для кожи, глаз и яиц земноводных) и такие заболевания, как хитридиомикоз. Антропогенные факторы рассматриваются главной причиной сокращений популяций земноводных в историческое время. Обезлесение приводит к сильному изменению и разрушению биотопов суши, пересыханию водоёмов, используемых земноводными для размножения. Наиболее уязвимыми являются лесные и горные виды. Второе место занимает осушение либо загрязнение водоёмов, главным образом пестицидами и синтетическими удобрениями, что вызывает уничтожение биотопов, где проходит развитие наиболее уязвимых стадий жизненного цикла (эмбрионов и личинок), а также приводит к фрагментации популяций. Наиболее опасным является промышленное загрязнение водоёмов, поскольку земноводные на личиночных и постметаморфозных стадиях могут накапливать в своих организмах тяжёлые металлы[244]. Негативно на численности популяций сказывается и урбанизация. Усиленный либо массовый отлов (особенно для террариумистики) также может быть фактором сокращения популяций[245]. Из прочих факторов важную роль играют интродуцированные хищники. Например, в ряде мест на Кавказе енот-полоскун стал массовым хищником, истребляющим местные виды земноводных. Большое влияние на численность популяций земноводных в Европе оказывает ротан, интродуцированный в начале XX века. Чернобрюхая дискоязычная лягушка считалась вымершей с 1943 года и была вновь обнаружена в 2011 году. Синантропные млекопитающие (собаки, кошки, лисы) и птицы (серые вороны, сороки) представляют угрозу земноводным, обитающим на территории населенных пунктов и их окрестностей[246]. Некоторые причины сокращения численности амфибий до сих пор неизвестны и являются предметом постоянных дискуссий[247][248][249][250][251].
Группа специалистов по земноводным из МСОП возглавляет усилия по реализации глобальной стратегии сохранения земноводных[252]. Ковчег амфибий — это организация, которая была создана для реализации рекомендаций по сохранению земноводных, и они работают с зоопарками и аквариумами по всему миру. Одним из таких проектов является проект по спасению и сохранению амфибий в Панаме[253].
Многие исследователи считают, что повышенная чувствительность земноводных в частности к загрязнению окружающей среды связана с такими факторами, как их промежуточная позиция в пищевой цепи, проницаемая кожа и жизненный цикл, включающий в себя водную стадию (головастик) и наземный образ жизни взрослой особи[254]. Те немногочисленные виды бесхвостых, у которых водный этап жизни сокращён или отсутствует вообще, обладают большей сопротивляемостью загрязнению, нежели типичные бесхвостые, развивающиеся в воде со стадии икринки до конца метаморфоза[255].
Исследование, проведённое в Канаде в 2006 году, показало, что высокая плотность транспорта является для земноводных большей угрозой, нежели ухудшение среды обитания[256]. В некоторых случаях были основаны программы размножения в неволе, которые, как правило, увенчивались успехом[257][258]. В 2007 году было опубликовано исследование, показавшее, что некоторые пробиотические бактерии могут повышать сопротивляемость бесхвостых летальным грибковым заболеваниям[259]. Была разработана программа «Панамский проект по спасению и сохранению амфибий» (англ. The Panama Amphibian Rescue and Conservation Project) для сохранения некоторых видов бесхвостых в восточной Панаме, гибнущих от этих заболеваний, включающая разработку полевых методов использования пробиотиков[260]. Всемирная ассоциация зоопарков и аквариумов (англ. World Association of Zoos and Aquariums) объявила 2008 год годом лягушки с целью привлечения внимания общественности к проблеме охраны бесхвостых[261].
Другой мерой может стать прекращение использования лягушек для употребления в пищу. На Ближнем Востоке растущий аппетит к поеданию лягушачьих лапок и последующему сбору их в пищу уже был связан с увеличением количества комаров и, таким образом, имеет прямые последствия для здоровья человека[262].


В культуре
Земноводные играют важную роль в культуре, но, как отмечает исследователь культуры народов мира Мариан Млынарски, они, как и рептилии, не самые известные животные. Это способствовало формированию ложного представления об амфибиях: как правило, они считаются отталкивающими существами, вызывающими страх или отвращение. Это совершенно необоснованное мнение имело негативные последствия, в том числе и бездумное истребление этих животных[97].

С земноводными связано множество мифов и суеверий. Например считалось, что некоторые саламандры могут выживать в огне и даже жить в нём, как в среде обитания[97]. Протеи, в свою очередь, в Словении XVIII века считались детьми драконов, живущими в центре земли[263][264]. В прошлом древесным лягушкам приписывали способность предсказывать погоду, и они считались полезными в составлении прогнозов. По этой причине её содержали в специальных высоких террариумах. Их и сейчас иногда содержат в качестве домашних питомцев, а также популярную в разведении изумрудную австралийскую квакшу[265].
В библейской Книге Исход размножение жаб является вторым бедствием в Египте[266].
Ян Парандовски называет Лернейскую гидру, чудовище болот из древнегреческой мифологии, «отвратительной амфибией»[267]. Слово «тритон», которым сегодня описывают тритонов, происходит из греческой мифологии. Это было имя одного морского бога, сына Посейдона, и оно означало целую расу морских существ, наполовину людей, наполовину чудовищ. В корейской мифологии есть правитель по имени Кымва, или «Золотая лягушка»[268]. Названия мест и организаций также связаны с амфибиями[269].
Волосатая лягушка заняла первое место в списке самых странных животных в мире, составленном сайтом New Scientist[270]. Благодаря своим причудливым «когтям» её сравнивают с героями комиксов и фильмов, например с Росомахой[271].

Большее внимание в культуре уделено бесхвостым земноводным. У многих народов мира лягушки, а ещё в большей степени жабы, ассоциировались с целым рядом неприятных свойств[272]. В китайской традиции лягушка символизирует лунное «Инь». Дух лягушки Цин-ва Шэн ассоциируется с излечением и удачей в делах. Символ «лягушка в колодце» относится к человеку недалёкому[273]. В европейском фольклоре жабы ассоциировались с ведьмами как фамилиары, источники ингредиентов для магических зелий, а иногда имели собственные магические свойства[274]. В египетской мифологии богиня-лягушка Хекат символизировала плодородие[273]. В древнеперуанской культуре Моче бесхвостые были одними из почитаемых животных и часто появлялись в произведениях искусства[275]. Легенда Панамы гласит, что удача сопутствует тому, кто увидит панамскую золотую лягушку (Atelopus zeteki). В варианте этой легенды говорится, что, умирая, эти лягушки превращаются в золотой талисман уаку[276].


Бесхвостые часто выступают в качестве персонажей в литературе[277]. Первое дошедшее до нас художественное произведение, в названии которого фигурируют бесхвостые — это комедия Аристофана «Лягушки», впервые поставленная в 405 году до н. э.[278]. В качестве дополнительных примеров можно привести: «Батрахомиомахия» — написанная гекзаметром древнегреческая пародийная поэма о войне мышей и лягушек; Царевна-Лягушка — персонаж одноимённой русской народной сказки; рассказ Константина Паустовского «Квакша» рассказывает о древесной лягушке; Король-лягушонок — персонаж сказки братьев Гримм «Сказка о Короле-лягушонке, или о Железном Генрихе»[279]. Мичиган Джей Фрог — мультипликационный персонаж, созданный студией Warner Bros[280]. В мультфильмах «Шрек 2» и «Шрек 3» лягушка (жаба) — истинный облик короля Гарольда. Европейская геральдическая традиция приписывала сатане герб с тремя лягушками и золотым поясом на червлёном фоне[281]. Лягушка Leptodactylus fallax, эндемик, встречающийся только на островах Монтсеррат и Доминика, запечатлена на гербе Доминики. Герб латвийского города Баложи — лягушка, сидящая под тремя листьями водяной лилии. Лягушонок Кермит — кукольный персонаж, режиссёр музыкального театра «Маппет-шоу» и один из персонажей детской образовательной телепередачи «Улица Сезам»[282].
Наука
Наука о земноводных иногда называется батрахологией, однако официально признанной такой науки нет. В первую очередь это связано с тем, что узких специалистов исключительно по амфибиям практически нет[283]. Признанная наука о амфибиях и рептилиях — это герпетология. Она, в свою очередь, является частью более широкой науки: зоологии, хотя редко земноводные расматриваются в её рамках. Исследования в этой области касаются таксономии, морфологии, этологии, экологии, физиологии и биохимии животных. Результаты исследований подлежат научному рецензированию и публикации в научных журналах. Профессионалы проводят полевые работы, исследования в университетах, обучают студентов, управляют музеями и зоопарками, разводят и продают земноводных и управляют дикой природой. Они объединяются в научные общества (например, Общество изучения амфибий и рептилий (SSAR) и Societas Europaea Herpetologica (SEH)) и публикуют статьи в научных журналах, посвящённых герпетологии (например, Amphibia-Reptilia). Одним из самых крупных герпетологических обществ является «Society for the Study of Amphibians and Reptiles». Это крупнейшее международное герпетологическое общество, признанное во всем мире за самую разнообразную программу публикаций, встреч и других мероприятий[284].
Комитет по сохранению животных SSAR доводит вопросы сохранения различных видов рептилий и амфибий, до сведения государственных и федеральных государственных учреждений, неправительственных организаций и герпетологов во всем мире. Комитет служит связующим звеном между SSAR и общественными и частными группами для предоставления экспертных советов, фактических знаний и образовательной информации о проблемах, с которыми сталкиваются земноводные и рептилии, включая защиту среды обитания находящихся под угрозой исчезновения видов, находящихся под угрозой исчезновения, а также виды, вызывающие особую озабоченность, коммерческое и частное использование, загрязнители и приоритеты для исследований, ориентированных на сохранение видов. Комитет координирует ответы SSAR на предлагаемое национальное и международное законодательство и другие вопросы сохранения, касающиеся рептилий и амфибий. Официальные ответы представляются на утверждение Президенту и Секретарю до публичного обнародования. Председатель представляет годовой отчёт Секретарю до ежегодного собрания Совета. SSAR также поддерживает многочисленные программы грантов, международные обмены и международные совместные усилия в области исследований и публикаций. Общество было основано как региональная организация Герпетологическое общество Огайо (OHS) двумя молодыми, но серьёзными любителями, Крейгом Адлером и Дэвидом М. Деннисом, которым тогда было 16 и 17 лет соответственно. Осенью 1957 года они решили формализовать взаимодействие между небольшой группой герпетологов-любителей по всему Огайо и в январе 1958 года начали издавать объединённый журнал и информационный бюллетень (названный «Трёхмесячный отчёт»). Название общества было изменено на «Общество по изучению амфибий и рептилий» 1 января 1967 г[285].
См. также
Примечания
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 1,16 1,17 1,18 1,19 1,20 1,21 Акимушкин И. И. Мир животных. Птицы, рыбы, земноводные и пресмыкающиеся. — 2-е. — М.: Мысль, 1989. — Т. 2. — С. 384—401. — 466 с. — ISBN 5-244-00307-0.
- ↑ 2,0 2,1 2,2 Дунаев, 2012, с. 8.
- ↑ Ежегодно открывается 200-300 видов, однако более трети известных находятся под угрозой исчезновения. По данным сайта AmphibiaWeb. Anura (Frogs), Caudata (Salamanders), Gymnophiona (Caecilians). Species List (на 16. 09. 2022).
- ↑ Amphibian Species of the World (англ.). База данных амфибий. Darrel Frost and The American Museum of Natural History. Дата обращения: 29 сентября 2017. Архивировано 22 июня 2012 года.
- ↑ Classis AMPHIBIA (Л. Я. Боркин, 1992). Дата обращения: 13 марта 2012. Архивировано 21 февраля 2012 года.
- ↑ Baird D. Paleozoic lepospondyl amphibians (англ.) // Integrative and Comparative Biology. — Oxford University Press, 1965. — Vol. 5, no. 2. — P. 287—294. — doi:10.1093/icb/5.2.287.
- ↑ Frost Darell. American Museum of Natural History: Amphibian Species of the World 5.5, an Online Reference. Herpetology. The American Museum of Natural History (2011). Дата обращения: 9 августа 2012. Архивировано 9 марта 2013 года.
- ↑ Crump Martha L. Amphibian diversity and life history (неопр.) // Amphibian Ecology and Conservation. A Handbook of Techniques. — 2009. — С. 3—20. Архивировано 15 июля 2011 года. Архивированная копия (недоступная ссылка). Дата обращения: 26 февраля 2013. Архивировано 15 июля 2011 года.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 9,11 9,12 9,13 9,14 9,15 9,16 9,17 9,18 9,19 9,20 9,21 9,22 9,23 9,24 9,25 9,26 9,27 9,28 9,29 9,30 9,31 9,32 Robert C. Stebbins. A natural history of amphibians. — Princeton, N.J.: Princeton University Press, 1995. — С. 56—87. — xvi, 316 pages с. — ISBN 0-691-03281-5, 978-0-691-03281-8, 0-691-10251-1, 978-0-691-10251-1.
- ↑ Blackburn D. C, Wake D. B. Class Amphibia Gray, 1825. In: Zhang, Z.-Q. (Ed.) Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness (англ.) // Zootaxa : journal. — 2011. — Vol. 3148. — P. 39—55.
- ↑ Speer B. W, Waggoner Ben. Amphibia: Systematics. University of California Museum of Paleontology (1995). Дата обращения: 13 декабря 2012. Архивировано 9 марта 2013 года.
- ↑ Anderson J., Reisz R., Scott D., Fröbisch N., Sumida S. A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders (англ.) // Nature : journal. — 2008. — Vol. 453, no. 7194. — P. 515—518. — doi:10.1038/nature06865. — PMID 18497824.
- ↑ Roček Z. Amphibian Biology: Paleontology: The Evolutionary History of Amphibians (англ.) / Heatwole, H.; Carroll, R. L.. — Surrey Beatty & Sons, 2000. — P. 1295—1331. — ISBN 978-0-949324-87-0.
- ↑ Jenkins Farish A. Jr, Walsh D. M, Carroll R. L. Anatomy of Eocaecilia micropodia, a limbed caecilian of the Early Jurassic (англ.) // Bulletin of the Museum of Comparative Zoology : journal. — 2007. — Vol. 158, no. 6. — P. 285—365. — doi:10.3099/0027-4100(2007)158[285:AOEMAL]2.0.CO;2.
- ↑ Gaoa K-Q, Shubin N. H. Late Jurassic salamandroid from western Liaoning, China (англ.) // Proceedings of the National Academy of Sciences. — United States National Academy of Sciences, 2012. — Vol. 109, no. 15. — P. 5767—5772. — doi:10.1073/pnas.1009828109.
- ↑ Cannatella David. Salientia. Tree of Life Web Project (2008). Дата обращения: 31 августа 2012. Архивировано 9 марта 2013 года.
- ↑ 17,0 17,1 17,2 Edwin Nicholas Arnold. A field guide to the reptiles and amphibians of Britain and Europe. — London: Collins, 1978. — 272 pages, 40 pages of plates с. — ISBN 0-00-219318-3, 978-0-00-219318-4.
- ↑ Ford L. S., Cannatella D. C. The Major Clades of Frogs // Herpetological Monographs. — 1993. — Т. 7. — P. 94–117. — ISSN 0733-1347. — doi:10.2307/1466954.
- ↑ J. Faivovich, C. Haddad, P. Garcia, D. Frost, Jonathan A. Campbell. SYSTEMATIC REVIEW OF THE FROG FAMILY HYLIDAE, WITH SPECIAL REFERENCE TO HYLINAE: PHYLOGENETIC ANALYSIS AND TAXONOMIC REVISION. — 2005. — doi:10.1206/0003-0090(2005)294[0001:SROTFF]2.0.CO;2.
- ↑ Frost, D. R.; Grant, T.; Faivovich, J.; Bain, R. H.; Haas, A.; Haddad, C. F. B.; de Sa, R. O.; Channing, A.; Wilkinson, M.; Donnellan, S. C.; Raxworthy, C. J.; Campbell. J. A.; Blotto, B. L.; Moler, P.; Drewe, R. C.; Nussbaum, R. A.; Lynch, J. D.; Green, D. M.; Wheeler, W. C. The Amphibian Tree of Life (англ.) // Bulletin of the American Museum of Natural History. — American Museum of Natural History, 2006. — Vol. 297. — P. 1—291. — doi:10.1206/0003-0090(2006)297[0001:TATOL]2.0.CO;2.
- ↑ Trait Evolution on a Phylogenetic Tree | Learn Science at Scitable (англ.). www.nature.com. Дата обращения: 10 сентября 2022.
- ↑ Allan Larson, Walter W. Dimmick. Phylogenetic Relationships of the Salamander Families: An Analysis of Congruence among Morphological and Molecular Characters // Herpetological Monographs. — 1993. — Т. 7. — С. 77–93. — ISSN 0733-1347. — doi:10.2307/1466953.
- ↑ Kathryn R. Elmer, Ronald M. Bonett, David B. Wake, Stephen C. Lougheed. Early Miocene origin and cryptic diversification of South American salamanders. National Library of Medicine (4 марта 2013).
- ↑ Heather Heying. Cryptobranchidae (Giant Salamanders, Hellbenders) (англ.). Animal Diversity Web. Дата обращения: 10 сентября 2022.
- ↑ Mayasich J, Grandmaison, D. Phillips C. Eastern Hellbender Status Assessment Report (англ.). web.archive.org (4 сентября 2012). Дата обращения: 10 сентября 2022.
- ↑ Encyclopedia of Reptiles & Amphibians. — 2nd ed. — San Diego, CA, 1998. — 240 pages с. — ISBN 0-12-178560-2, 978-0-12-178560-4.
- ↑ R. Alexander Pyron; John J. Wiens. A large-scale phylogeny of Amphibia including over 2800 species, and a revised classification of extant frogs, salamanders, and caecilians (англ.) // Molecular Phylogenetics and Evolution : journal. — Academic Press, 2011. — Vol. 61, no. 2. — P. 543—583. — doi:10.1016/j.ympev.2011.06.012. — PMID 21723399.
- ↑ 28,0 28,1 Robert L. Dorit, 1991, с. 852.
- ↑ [http://ib.berkeley.edu/labs/mwake/papers/23.PDF Fetal Maintenance and Its Evolutionary Significance in the Amphibia: Gymnophiona] // Journal of Herpetology. — Oct. 31, 1977. — С. 379-386.
- ↑ A nine-family classification of caecilians (Amphibia: Gymnophiona). web.archive.org (31 мая 2012). Дата обращения: 22 сентября 2022.
- ↑ San Mauro Diego, Gower David J., Müller Hendrik, Loader Simon P., Zardoya Rafael, Nussbaum Ronald A., Wilkinson Mark. Life-history evolution and mitogenomic phylogeny of caecilian amphibians (англ.) // Molecular Phylogenetics and Evolution. — 2014. — April (vol. 73). — P. 177—189. — ISSN 1055-7903. — doi:10.1016/j.ympev.2014.01.009.
- ↑ Freaky Frogs. National Geographic Explorer. Дата обращения: 13 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Ferrell, Vance. Geographical Distribution. Evolution Encyclopedia, Volume 3. Evolution Facts (4 марта 2012). Дата обращения: 13 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Introduced frogs. New Zealand Frog Research Group (2006). Дата обращения: 7 октября 2012. Архивировано 17 октября 2012 года.
- ↑ Ryan, Paddy. Story: Frogs. The Encyclopedia of New Zealand (25 сентября 2011). Дата обращения: 20 августа 2012. Архивировано 17 октября 2012 года.
- ↑ Dahl, Chris; Novotny, Vojtech; Moravec, Jiri; Richards, Stephen J. Beta diversity of frogs in the forests of New Guinea, Amazonia and Europe: contrasting tropical and temperate communities (англ.) // Journal of Biogeography : journal. — 2009. — Vol. 36, no. 5. — P. 896‑904. — doi:10.1111/j.1365-2699.2008.02042.x.
- ↑ Cyclorana platycephala (недоступная ссылка). Frogs Australia Network (23 февраля 2005). Дата обращения: 20 июля 2012. Архивировано 24 августа 2006 года.
- ↑ Exploratorium: Frogs: The Amazing, Adaptable Frog / Page 1 of 6. www.exploratorium.edu. Дата обращения: 16 сентября 2022.
- ↑ 39,0 39,1 39,2 39,3 The History of Animal Evolution (англ.). sci.waikato.ac.nz. Дата обращения: 29 августа 2022.
- ↑ Ke-Qin Gao, Neil H. Shubin. Late Jurassic salamandroid from western Liaoning, China (англ.) // Proceedings of the National Academy of Sciences. — 2012-04-10. — Vol. 109, iss. 15. — P. 5767–5772. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.1009828109.
- ↑ 41,0 41,1 41,2 Patterns of evolution, as illustrated by the fossil record. — Elsevier, 1977-01-15. — 607 с. — ISBN 978-0-08-086846-2.
- ↑ Ralf Werneburg, Ausonio Ronchi, Jörg W. Schneider. The Early Permian Branchiosaurids (Amphibia) of Sardinia (Italy): Systematic Palaeontology, Palaeoecology, Biostratigraphy and Palaeobiogeographic Problems (англ.) // Palaeogeography, Palaeoclimatology, Palaeoecology. — 2007-09-03. — Vol. 252, iss. 3. — P. 383–404. — ISSN 0031-0182. — doi:10.1016/j.palaeo.2007.03.048.
- ↑ 43,0 43,1 Spoczynska J. O. I. Fossils: A Study in Evolution. — 1971. — С. 120—125. — ISBN 978-0-584-10093-8.
- ↑ Joy O. I. Spoczynska. Fossils: a study in evolution. — London,: Muller, 1971. — С. 56. — 208 pages с. — ISBN 0-584-10093-0, 978-0-584-10093-8.
- ↑ Sahney S, Benton M.J. & Ferry P.A. Links between global taxonomic diversity, ecological diversity and the expansion of vertebrates on land // Biology Letters. — 2010.
- ↑ San Mauro D. A multilocus timescale for the origin of extant amphibians // Molecular Phylogenetics and Evolution. — 2010.
- ↑ Diego San Mauro, Miguel Vences, Marina Alcobendas, Rafael Zardoya, Axel Meyer. Initial diversification of living amphibians predated the breakup of Pangaea // The American Naturalist. — 2005. — Т. 165, вып. 5. — С. 590–599. — ISSN 0003-0147. — doi:10.1086/429523.
- ↑ 48,0 48,1 Jason S. Anderson, Robert R. Reisz, Diane Scott, Nadia B. Fröbisch, Stuart S. Sumida. A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders // Nature. — 2008. — Т. 453, вып. 7194. — С. 515. — ISSN 0028-0836.
- ↑ Casselman, Anne. "Frog-amander" fossil may be amphibian missing link (21 мая 2008). Архивировано 13 октября 2012 года. Дата обращения 5 июля 2012.
- ↑ Anderson, Jason S.; Reisz, Robert R.; Scott, Diane; Fröbisch, Nadia B.; Sumida, Stuart S. A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders (англ.) // Nature : journal. — 2008. — Vol. 453. — P. 515—518. — doi:10.1038/nature06865.
- ↑ 51,0 51,1 Tiny fossils reveal backstory of the most mysterious amphibian alive (англ.). ScienceDaily. Дата обращения: 29 августа 2022.
- ↑ MAGDALENA BORSUK−BIAŁYNICKA and SUSAN E. EVANS. The scapulocoracoid of an Early Triassic stem−frog from Poland // Acta Palaeontologica Polonica. — 2002.
- ↑ Robert L. Dorit, 1991, с. 843–859.
- ↑ The Science Computer Cluster Facility is a major resource used to advance and support our research and educational initiatives. Computational Sciences.
- ↑ World’s Smallest Vertebrate | 2013 Top 10 Species | ESF Top 10 New Species. www.esf.edu. Дата обращения: 17 сентября 2022.
- ↑ Frog Fun Facts (англ.). American Museum of Natural History.
- ↑ Gymnophiona | amphibian | Britannica (англ.). www.britannica.com. Дата обращения: 9 сентября 2022.
- ↑ Amphibian Facts. amphibiaweb.org. Дата обращения: 9 сентября 2022.
- ↑ Земноводные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Wayback Machine. web.archive.org (25 июля 2020). Дата обращения: 12 сентября 2022.
- ↑ Sequence variation in the melanocortin-1 receptor gene (Mc1r) does not explain variation in the degree of melanism in a widespread amphibian // Finnish Zoological and Botanical Publishing Board.
- ↑ Jussi S. Alho, Gábor Herczeg, Fredrik Söderman, Anssi Laurila, K. Ingemar Jönsson. Increasing melanism along a latitudinal gradient in a widespread amphibian: local adaptation, ontogenic or environmental plasticity? // BMC Evolutionary Biology. — 2010-10-21. — Т. 10, вып. 1. — С. 317. — ISSN 1471-2148. — doi:10.1186/1471-2148-10-317.
- ↑ 63,0 63,1 Vitt & Caldwell, 2014, p. 48.
- ↑ R. I. C. Spearman. The integument: a textbook of skin biology,. — London,: Cambridge University Press, 1973. — vii, 208, [8] pages с. — ISBN 0-521-20048-2, 978-0-521-20048-6.
- ↑ Richard Ian Campbell Spearman. The Integument. — CUP Archive, 1973-06-28. — 232 с. — ISBN 978-0-521-20048-6.
- ↑ Robert L. Dorit, 1991, с. 842.
- ↑ Robert L. Dorit, 1991, с. 843.
- ↑ Robert L. Dorit, 1991, с. 844, 845.
- ↑ Grzegorz Niedźwiedzki, Piotr Szrek, Katarzyna Narkiewicz, Marek Narkiewicz, Per E. Ahlberg. Tetrapod trackways from the early Middle Devonian period of Poland (англ.) // Nature. — 2010-01. — Vol. 463, iss. 7277. — P. 43–48. — ISSN 1476-4687. — doi:10.1038/nature08623.
- ↑ 70,0 70,1 70,2 70,3 70,4 70,5 70,6 Robert L. Dorit. Zoology. — Philadelphia: Saunders College Pub., 1991. — С. 843—878. — 1126 с. — ISBN 978-0-03-030504-7.
- ↑ Х. Харольд, Роберт Л. Кэрролл. Общая биология амфибий // Эволюционная история.
- ↑ Robert L. Dorit, 1991, с. 848.
- ↑ 73,0 73,1 Michał Walski. Badania ultrastrukturalne rozwoju bariery krew-powietrze w płucach kręgowców ze szczególnym uwzględnieniem systemu surfaktantu // Warszawa: Dział Wydawnictw Akademii medycznej w Warszawie. — 1986.
- ↑ Robert L. Dorit, 1991, с. 849.
- ↑ Robert L. Dorit, 1991, с. 853.
- ↑ International review of cytology : a survey of cell biology. Volume 145. — San Diego: Academic Press, 1993. — С. 66. — 1 online resource (x, 331 pages) с. — ISBN 978-0-08-058683-0, 0-08-058683-X, 0-12-364548-4, 978-0-12-364548-7.
- ↑ Практикум по зоологии позвоночных. Вскрытие земноводного. Дата обращения: 24 октября 2012. Архивировано 8 сентября 2013 года. Проверено 16 июля 2012.
- ↑ Robert L. Dorit, 1991, с. 855.
- ↑ Robert L. Dorit, 1991, с. 857.
- ↑ Лимфатические сердца // Большая Советская Энциклопедия / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская Энциклопедия, 1973. — Т. 14 : Куна — Ломами. — С. 450. — 629 000 экз.
- ↑ Robert L. Dorit, 1991, с. 858.
- ↑ Robert L. Dorit, 1991, с. 859.
- ↑ Frogs re-evolved lost lower teeth. Дата обращения: 21 сентября 2018. Архивировано 28 июля 2011 года.
- ↑ Wiens, J.J. Re-Evolution of Lost Mandibular Teeth in Frogs After More Than 200 Million Years, and Re-Evaluating Dollo's Law // Evolution. — 2011. — Vol. 65. — P. 1283-1296. — doi:10.1111/j.1558-5646.2011.01221.x.
- ↑ Robert L. Dorit, 1991, с. 834.
- ↑ H Oberleithner, M Weigt, H J Westphale, W Wang. Aldosterone activates Na+/H+ exchange and raises cytoplasmic pH in target cells of the amphibian kidney. (англ.) // Proceedings of the National Academy of Sciences. — 1987-03. — Vol. 84, iss. 5. — P. 1464–1468. — ISSN 1091-6490 0027-8424, 1091-6490. — doi:10.1073/pnas.84.5.1464.
- ↑ Никитенко, 1969. Головной мозг земноводных. Биология и медицина. Дата обращения: 13 марта 2012. Архивировано 16 декабря 2013 года.
- ↑ 88,0 88,1 88,2 88,3 88,4 88,5 Martin E. Feder, Warren W. Burggren. Environmental Physiology of the Amphibians. — University of Chicago Press, 1992-10-15. — 660 с. — ISBN 978-0-226-23944-6.
- ↑ 89,0 89,1 89,2 89,3 amphibian | Characteristics, Life Cycle, & Facts | Britannica (англ.). www.britannica.com. Дата обращения: 29 августа 2022.
- ↑ 90,0 90,1 Badger, David; Netherton, John. Frogs (англ.). — Airlife Publishing Ltd, 1995. — P. 31‑35. — ISBN 1853107409.
- ↑ Tesler, P. The amazing adaptable frog. Exploratorium:: The museum of science, art and human perception (1999). Дата обращения: 4 июня 2012. Архивировано 5 августа 2012 года.
- ↑ Muntz, W. R. A.; Scientific American Offprints. Vision in frogs (англ.). — W. H. Freeman, 1964. — P. 10.
- ↑ Maturana H. R., et al. Anatomy and physiology of vision in the frog (Rana pipiens) (англ.) // The Journal of General Physiology : журнал. — Rockefeller University Press, 1960. — No. 43. — P. 129.
- ↑ Grzimek, 2003, p. 26.
- ↑ Badger, David; Netherton, John. Frogs (англ.). — Airlife Publishing, 1995. — P. 38. — ISBN 1853107409.
- ↑ V. E. NEGUS. THE ORGAN OF JACOBSON // Ferens Institute, Middlesex Hospital, London.
- ↑ 97,0 97,1 97,2 97,3 97,4 97,5 97,6 97,7 97,8 Marian Młynarski. Płazy i gady Polski. — Warszawa: Państwowe Zakłady Wydawnictw Szkolnych, 1966. — С. 3.
- ↑ Dev Raj Khanna, P. R. Yadav. Biology of Amphibia. — Discovery Publishing House, 2005. — С. 7. — 412 с. — ISBN 978-81-7141-932-6.
- ↑ 99,0 99,1 Robert A. Newman. Adaptive Plasticity in Amphibian Metamorphosis // BioScience. — 1992. — Т. 42, вып. 9. — С. 671–678. — ISSN 0006-3568. — doi:10.2307/1312173.
- ↑ International Review of Cytology. — Academic Press, 1993-06-07. — 345 с. — ISBN 978-0-08-058683-0.
- ↑ AmphibiaWeb - Triturus cristatus. amphibiaweb.org. Дата обращения: 14 сентября 2022.
- ↑ Warkentin, K.M. Adaptive plasticity in hatching age: a response to predation risk trade-offs (англ.) // Proceedings of the National Academy of Sciences : journal. — National Academy of Sciences, 1995. — Vol. 92, no. 8. — P. 3507‑3510. — doi:10.1073/pnas.92.8.3507.
- ↑ Amphibian diversity and life history. web.archive.org (15 июля 2011). Дата обращения: 11 сентября 2022.
- ↑ Vitt & Caldwell, 2014.
- ↑ Ontogenetic Changes in Diet and Intestinal Morphology in Semi-Terrestrial Tadpoles of Nannophrys ceylonensis (Dicroglossidae). (недоступная ссылка)
- ↑ Janzen, Peter. Nannophrys ceylonensis. AmphibiaWeb. University of California, Berkeley (10 мая 2005). Дата обращения: 20 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Duellman, W. E.; Zug, G. R. Anura: From tadpole to adult. Encyclopædia Britannica. Дата обращения: 13 июля 2012. Архивировано 17 октября 2012 года.
- ↑ frog and toad | Types, Habitat, Diet, & Characteristics | Britannica (англ.). www.britannica.com. Дата обращения: 10 сентября 2022.
- ↑ Crump, Martha L. Cannibalism by younger tadpoles: another hazard of metamorphosis (англ.) // Copeia : journal. — American Society of Ichthyologists and Herpetologists, 1986. — Vol. 4. — P. 1007‑1009. — .
- ↑ Balinsky, Boris Ivan. Animal development: Metamorphosis. Encyclopedia Britannica. Дата обращения: 10 августа 2012. Архивировано 17 октября 2012 года.
- ↑ Campbell, Neil A.; Reece, Jane B. Biology (Sixth edition) (англ.). — Pearson Education, 2002. — P. 692. — ISBN 0-201-75054-6.
- ↑ frog and toad | Types, Habitat, Diet, & Characteristics, Encyclopedia Britannica. Дата обращения 29 августа 2022.
- ↑ René van Wijngaarden, Federico Bolaños. Parental Care in Dendrobates granuliferus (Anura: Dendrobatidae), with a Description of the Tadpole // Journal of Herpetology. — 1992. — Т. 26, вып. 1. — С. 102–105. — ISSN 0022-1511. — doi:10.2307/1565037.
- ↑ 114,0 114,1 H. Bradley Shaffer, C. C. Austin, R. B. Huey. The Consequences of Metamorphosis on Salamander (Ambystoma) Locomotor Performance // Physiological Zoology. — 1991. — Т. 64, вып. 1. — С. 212–231. — ISSN 0031-935X.
- ↑ Wayback Machine. web.archive.org (10 февраля 2020). Дата обращения: 29 августа 2022.
- ↑ 116,0 116,1 Caudata | Characteristics & Facts | Britannica (англ.). www.britannica.com. Дата обращения: 29 августа 2022.
- ↑ 117,0 117,1 AmphibiaWeb - Ambystoma gracile. amphibiaweb.org. Дата обращения: 10 сентября 2022.
- ↑ 118,0 118,1 118,2 118,3 118,4 118,5 William E. Duellman. Biology of amphibians. — Johns Hopkins pbk. ed. — Baltimore: Johns Hopkins University Press, 1994. — xxi, 670 pages с. — ISBN 0-8018-4780-X, 978-0-8018-4780-6.
- ↑ Barry D. Valentine, David M. Dennis. A Comparison of the Gill-Arch System and Fins of Three Genera of Larval Salamanders, Rhyacotriton, Gyrinophilus, and Ambystoma // Copeia. — 1964. — Т. 1964, вып. 1. — С. 196–201. — ISSN 0045-8511. — doi:10.2307/1440850.
- ↑ William E. Duellman, Linda Trueb. Biology of Amphibians. — JHU Press, 1994-02. — С. 191–192. — 702 с. — ISBN 978-0-8018-4780-6.
- ↑ W. R. Breckenridge, Shirani Nathanael, Lionel Pereira. Some aspects of the biology and development of Ichthyophis glutinosus (Amphibia: Gymnophiona) (англ.) // Journal of Zoology. — 1987-03. — Vol. 211, iss. 3. — P. 437–449. — ISSN 1469-7998 0952-8369, 1469-7998. — doi:10.1111/jzo.1987.211.3.437.
- ↑ Marvalee H. Wake. Fetal Maintenance and Its Evolutionary Significance in the Amphibia: Gymnophiona // Journal of herpetology. — October 1977.
- ↑ One hundred million years of skin feeding? Extended parental care in a Neotropical caecilian (Amphibia: Gymnophiona).
- ↑ Александр Марков. Как земноводные учились превращаться (недоступная ссылка) (24 января 2008). Дата обращения: 13 марта 2012. Архивировано 15 июня 2013 года.
- ↑ Da Silva, H. R.; De Britto-Pereira, X. C. How much fruit do fruit-eating frogs eat? An investigation on the diet of Xenohyla truncata (Lissamphibia: Anura: Hylidae) (англ.) // Journal of Zoology : journal. — Wiley-Blackwell, 2006. — Vol. 270, no. 4. — P. 692—698. — doi:10.1111/j.1469-7998.2006.00192.x.
- ↑ Graham, Donna. Northern leopard frog (Rana pipiens). An Educator's Guide to South Dakota's Natural Resources. Дата обращения: 4 августа 2012. Архивировано 17 октября 2012 года.
- ↑ Pimm, Stuart L. The structure of food webs (англ.) // Theoretical Population Biology. — Elsevier, 1979. — Vol. 16, no. 2. — P. 144—158. — doi:10.1016/0040-5809(79)90010-8. — PMID 538731. Архивировано 27 сентября 2011 года. Архивированная копия (недоступная ссылка). Дата обращения: 13 сентября 2012. Архивировано 27 сентября 2011 года.
- ↑ Matthews, K. R.; Miaud, C. A skeletochronological study of the age structure, growth, and longevity of the mountain yellow-legged frog, Rana muscosa, in the Sierra Nevada, California (англ.) // Copeia : journal. — American Society of Ichthyologists and Herpetologists, 2007. — Vol. 2007, no. 4. — P. 986—993. — ISSN 0045-8511. — doi:10.1643/0045-8511(2007)7[986:ASSOTA]2.0.CO;2.
- ↑ Slavens .; Slavens K. Frog and toad index. Longevity. Дата обращения: 4 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Susan E. Evans, Joseph R. Groenke, Marc E. H. Jones, Alan H. Turner, and David W. Krause. New Material of Beelzebufo, a Hyperossified Frog (Amphibia: Anura) from the Late Cretaceous of Madagascar // PLoS One.
- ↑ Advances in the study of behavior. — Amsterdam: Elsevier, 2012. — P. 109–144. — ISBN 978-0-12-004501-3.
- ↑ Jason L. Brown, Victor Morales, Kyle Summers. A Key Ecological Trait Drove the Evolution of Biparental Care and Monogamy in an Amphibian // The American Naturalist. — 2010. — Т. 175, № 4. — P. 436. — ISSN 0003-0147.
- ↑ Search Entire FWS Site | U.S. Fish & Wildlife Service (англ.). FWS.gov. Дата обращения: 29 августа 2022.
- ↑ Proteins of frog foam nests. University of Glasgow. Дата обращения: 24 августа 2012. Архивировано 17 октября 2012 года.
- ↑ Dalgetty, Laura; Kennedy, Malcolm W. Building a home from foam—túngara frog foam nest architecture and three-phase construction process (англ.) // Biology Letters : journal. — Royal Society Publishing, 2010. — Vol. 6, no. 3. — P. 293—296. — doi:10.1098/rsbl.2009.0934. — PMID 20106853.
- ↑ AmphibiaWeb - Alytes obstetricans. amphibiaweb.org. Дата обращения: 11 сентября 2022.
- ↑ Вечные странники - начало. www.sivatherium.narod.ru. Дата обращения: 11 сентября 2022.
- ↑ Michael J. Tyler, David B. Carter. Oral birth of the young of the gastric brooding frog Rheobatrachus silus (англ.) // Animal Behaviour. — 1981-02-01. — Vol. 29, iss. 1. — P. 280–282. — ISSN 0003-3472. — doi:10.1016/S0003-3472(81)80175-3.
- ↑ Erica Semeyn. Rheobatrachus silus (англ.). Animal Diversity Web. Дата обращения: 11 сентября 2022.
- ↑ Parental Care in Dendrobates granuliferus (Anura: Dendrobatidae), with a Description of the Tadpole.
- ↑ René van Wijngaarden, Federico Bolaños. Parental Care in Dendrobates granuliferus (Anura: Dendrobatidae), with a Description of the Tadpole // Journal of herpetology. — March 1992.
- ↑ Terrestrial Vertebrates. tolweb.org. Дата обращения: 9 сентября 2022.
- ↑ G. Hopkins, E. D. Brodie. Occurrence of Amphibians in Saline Habitats: A Review and Evolutionary Perspective. — 2015. — doi:10.1655/HERPMONOGRAPHS-D-14-00006.
- ↑ Питание земноводных. Биологи и медицина. Дата обращения: 13 марта 2012. Архивировано 2 декабря 2013 года.
- ↑ H. R. da Silva, M. C. de Britto-Pereira. How much fruit do fruit-eating frogs eat? An investigation on the diet of Xenohyla truncata (Lissamphibia: Anura: Hylidae) // Journal of Zoology. — 2006. — Т. 270, вып. 4. — С. 692–698. — ISSN 0952-8369.
- ↑ Stephanie Sickler. Siren intermedia (Lesser Siren) (англ.). Animal Diversity Web. Дата обращения: 11 сентября 2022.
- ↑ 147,0 147,1 J. Zool., Lond. Feeding specializations of the Mexican burrowing toad, Rhinophrynus dorsalis (Anura: Rhinophrynidae) // Department of Systematics and Ecology and the Museum ofNatural History, The University o fKansas, Lawrence, Kansas 66045, U.S.A.. — 1983. — С. 199, 189-208.
- ↑ W. J. Hamilton. The Food and Feeding Behavior of the Green Frog, Rana clamitans Latreille, in New York State // Copeia. — 1948. — Т. 1948, вып. 3. — С. 203–207. — ISSN 0045-8511. — doi:10.2307/1438455.
- ↑ Charles W. Radcliffe, David Chiszar, Karen Estep, James B. Murphy, Hobart M. Smith. Observations on Pedal Luring and Pedal Movements in Leptodactylid Frogs // Journal of Herpetology. — 1986. — Т. 20, вып. 3. — С. 300–306. — ISSN 0022-1511. — doi:10.2307/1564496.
- ↑ Catherine A. Toft. Feeding Ecology of Panamanian Litter Anurans: Patterns in Diet and Foraging Mode // Journal of Herpetology. — 1981. — Т. 15, вып. 2. — С. 139. — ISSN 0022-1511.
- ↑ W. E. Bemis, K. Schwenk, M. H. Wake. Morphology and function of the feeding apparatus in Dermophis mexicanus (Amphibia: Gymnophiona) // Zoological Journal of the Linnean Society. — 1983. — Т. 77, вып. 1. — С. 75. — ISSN 0024-4082.
- ↑ Michael R. Crossland, Mark N. Hearnden, Ligia Pizzatto, Ross A. Alford, Richard Shine. Why be a cannibal? The benefits to cane toad, Rhinella marina [=Bufo marinus, tadpoles of consuming conspecific eggs] (англ.) // Animal Behaviour. — 2011-10-01. — Vol. 82, iss. 4. — P. 775–782. — ISSN 0003-3472. — doi:10.1016/j.anbehav.2011.07.009.
- ↑ Пищеварительная система земноводных. Биология и медицина. Дата обращения: 13 марта 2012. Архивировано 2 декабря 2013 года.
- ↑ Laura Dalgetty, Malcolm W. Kennedy. Building a home from foam—túngara frog foam nest architecture and three-phase construction process // Biology Letters. — 2010-06-23. — Т. 6, вып. 3. — С. 293–296. — doi:10.1098/rsbl.2009.0934.
- ↑ Abiotic factor. web.archive.org (8 июня 2013). Дата обращения: 10 сентября 2022.
- ↑ Top 10 best jumper animals. Scienceray. Дата обращения: 11 июня 2012. Архивировано 17 августа 2012 года.
- ↑ Nauwelaerts, S.; Schollier, J.; Aerts, P. A functional analysis of how frogs jump out of water (англ.) // Biological Journal of the Linnean Society : journal. — Oxford University Press, 2004. — Vol. 83, no. 3. — P. 413‑420. — doi:10.1111/j.1095-8312.2004.00403.x. — PMID 18190283.
- ↑ Badger, David; Netherton, John. Frogs (англ.). — Airlife Publishing, 1995. — P. 51. — ISBN 1853107409.
- ↑ Minott, Kevin. How frogs jump. National Geographic (15 мая 2010). Дата обращения: 10 июня 2012. Архивировано 17 августа 2012 года.
- ↑ Astley, H. C.; Roberts, T. J. Evidence for a vertebrate catapult: elastic energy storage in the plantaris tendon during frog jumping (англ.) // Biology Letters : journal. — Royal Society Publishing, 2011. — Vol. 8, no. 3. — P. 386—389. — doi:10.1098/rsbl.2011.0982.
- ↑ Scott, J. The locust jump: an integrated laboratory investigation (англ.) // Advances in Physiology Education : journal. — 2005. — Vol. 29, no. 1. — P. 21‑26. — doi:10.1152/advan.00037.2004.
- ↑ 162,0 162,1 Anura. Encyclopædia Britannica Online. Дата обращения: 12 июня 2012. Архивировано 17 августа 2012 года.
- ↑ 163,0 163,1 Fitch, H. S. An ecological study of the collared lizard (Crotaphytus collaris) (англ.) // University of Kansas Publications : journal. — Museum of Natural History, 1956. — Vol. 8. — P. 213‑274.
- ↑ Emerson, Sharon B.; Koehl, M. A. R. The interaction of behavioral and morphological change in the evolution of a novel locomotor type: "flying frogs (англ.) // Evolution : journal. — Wiley-VCH, 1990. — Vol. 44, no. 8. — P. 1931‑1946. — .
- ↑ Shah, Sunny; Tiwari, Rachna. Rhacophorus nigropalmatus. AmphibiaWeb. University of California, Berkeley (29 ноября 2001). Дата обращения: 11 июня 2012. Архивировано 17 августа 2012 года.
- ↑ Wallace's Flying Frog Rhacophorus nigropalmatus. National Geographic: Animals. Дата обращения: 5 июня 2012. Архивировано 17 августа 2012 года.
- ↑ Brian K. Sullivan. Sexual Selection and Calling Behavior in the American Toad (Bufo americanus) // Copeia. — 1992. — Т. 1992, вып. 1. — С. 1–7. — ISSN 0045-8511. — doi:10.2307/1446530.
- ↑ Wayback Machine. web.archive.org (4 сентября 2012). Дата обращения: 9 сентября 2022.
- ↑ WEC218/UW259: The Cuban Treefrog (Osteopilus septentrionalis) in Florida. web.archive.org (20 августа 2012). Дата обращения: 11 сентября 2022.
- ↑ Bullfrog. Ohio Department of Natural Resources. Дата обращения: 19 июня 2012. Архивировано 5 августа 2012 года.
- ↑ 171,0 171,1 Nafis, Gary. Ascaphus truei: Coastal Tailed Frog. California Herps (2012). Дата обращения: 1 августа 2012. Архивировано 5 августа 2012 года.
- ↑ Roy, Debjani. Communication signals and sexual selection in amphibians (англ.) // Current Science : journal. — 1997. — Vol. 72. — P. 923‑927.
- ↑ Gerhardt, H. C. The evolution of vocalization in frogs and toads (англ.) // Annual Review of Ecology, Evolution, and Systematics. — Annual Reviews, 1994. — Vol. 25. — P. 293‑324. — doi:10.1146/annurev.es.25.110194.001453.
- ↑ 174,0 174,1 174,2 174,3 Badger, David; Netherton, John. Frogs (англ.). — Airlife Publishing Ltd, 1995. — P. 39—44. — ISBN 1853107409.
- ↑ AmphibiaWeb - Plethodon cinereus. amphibiaweb.org. Дата обращения: 11 сентября 2022.
- ↑ William F. Gergits, Robert G. Jaeger. Site Attachment by the Red-Backed Salamander, Plethodon cinereus // Journal of Herpetology. — 1990. — Т. 24, вып. 1. — С. 91–93. — ISSN 0022-1511. — doi:10.2307/1564297.
- ↑ Richard Shine. Sexual Selection and Sexual Dimorphism in the Amphibia // Copeia. — 1979. — Т. 1979, вып. 2. — С. 297–306. — ISSN 0045-8511. — doi:10.2307/1443418.
- ↑ Kentwood D. Wells. Territoriality and Male Mating Success in the Green Frog (Rana Clamitans) // Ecology. — 1977. — Т. 58, вып. 4. — С. 750–762. — ISSN 0012-9658. — doi:10.2307/1936211.
- ↑ Pierre Grimal. Słownik mitologii greckiej i rzymskiej. — Wyd. 3, dodruk. — Wrocław: Zakład Narodowy im. Ossolińskich - Wydawnictwo, dr. 2008. — С. 353, 354. — XLI, [1], 481, [2] s. с. — ISBN 978-83-04-04673-3, 83-04-04673-3.
- ↑ 180,0 180,1 George T. Barthalmus, William J. Zielinski. Xenopus skin mucus induces oral dyskinesias that promote escape from snakes (англ.) // Pharmacology Biochemistry and Behavior. — 1988-08-01. — Vol. 30, iss. 4. — P. 957–959. — ISSN 0091-3057. — doi:10.1016/0091-3057(88)90126-8.
- ↑ Edmund D. Brodie. Investigations on the Skin Toxin of the Adult Rough-Skinned Newt, Taricha granulosa // Copeia. — 1968. — Т. 1968, вып. 2. — С. 307–313. — ISSN 0045-8511. — doi:10.2307/1441757.
- ↑ Hanifin Charles T, Yotsu-Yamashita Mari, Yasumoto Takeshi, Brodie Edmund D, Brodie Edmund D. Jr. Toxicity of dangerous prey: variation of tetrodotoxin levels within and among populations of the newt Taricha granulosa (англ.) // Journal of Chemical Ecology. — 1999.
- ↑ S. Geffeney, E. Fujimoto, E. Brodie, P. Ruben. Evolutionary diversification of TTX-resistant sodium channels in a predator–prey interaction // Nature. — 2005. — doi:10.1038/nature03444.
- ↑ AmphibiaWeb - Xenopus laevis. amphibiaweb.org. Дата обращения: 9 сентября 2022.
- ↑ Ядовитая эволюция (недоступная ссылка). Журнал «Вокруг света». Дата обращения: 13 марта 2012. Архивировано 19 февраля 2008 года.
- ↑ Самый сильный яд // Биология / Сост. С. Т. Исмаилова. — 3-е изд. — М.: «Аванта+», 1996. — Т. 2. — С. 406—407. — 704 с. — (Энциклопедия для детей). — ISBN 5-86529-012-6.
- ↑ Dendrobatidae. www.tolweb.org. Дата обращения: 14 сентября 2022.
- ↑ Catherine R. Darst, Molly E. Cummings. Predator learning favours mimicry of a less-toxic model in poison frogs (англ.) // Nature. — 2006-03. — Vol. 440, iss. 7081. — P. 208–211. — ISSN 1476-4687. — doi:10.1038/nature04297.
- ↑ Jean-Marc Hero, Ed Meyer, Peter Robertson, Frank Lemckert, John Clarke. Notaden bennettii. The IUCN Red List of Threatened Species (2004).
- ↑ Darst, Catherine R.; Cummings, Molly E. Predator learning favours mimicry of a less-toxic model in poison frogs (англ.) // Nature : journal. — 2006. — Vol. 440. — P. 208‑211. — doi:10.1038/nature04297.
- ↑ Edmund D. Brodie, Robert T. Nowak, William R. Harvey. The Effectiveness of Antipredator Secretions and Behavior of Selected Salamanders against Shrews // Copeia. — 1979. — Т. 1979, вып. 2. — С. 270–274. — ISSN 0045-8511. — doi:10.2307/1443413.
- ↑ John T. Beneski. Adaptive Significance of Tail Autotomy in the Salamander, Ensatina // Journal of Herpetology. — 1989. — Т. 23, вып. 3. — С. 322–324. — ISSN 0022-1511. — doi:10.2307/1564465.
- ↑ Edmund D. Brodie. Biting and Vocalization as Antipredator Mechanisms in Terrestrial Salamanders // Copeia. — 1978. — Т. 1978, вып. 1. — С. 127–129. — ISSN 0045-8511. — doi:10.2307/1443832.
- ↑ Arnold, Nicholas; Ovenden, Denys. Reptiles and Amphibians of Britain and Europe (англ.). — Harper Collins Publishers, 2002. — P. 73‑74. — ISBN 0002199645.
- ↑ Hayes, Floyd E. Antipredator behavior of recently metamorphosed toads (Bufo a. americanus) during encounters with garter snakes (Thamnophis s. sirtalis) (англ.) // Copeia : journal. — American Society of Ichthyologists and Herpetologists, 1989. — Vol. 1989, no. 4. — P. 1011‑1015. — .
- ↑ Daniel L. Bottom, Martha H. Brookes, Gordon H. Reeves. Sustainability Issues for Resource Managers. — DIANE Publishing, 1996-06. — 61 с. — ISBN 978-0-7881-4699-2.
- ↑ W. Bryan Jennings, David F. Bradford, Dale F. Johnson. Dependence of the Garter Snake Thamnophis elegans on Amphibians in the Sierra Nevada of California // Journal of Herpetology. — 1992. — Т. 26, вып. 4. — С. 503–505. — ISSN 0022-1511. — doi:10.2307/1565132.
- ↑ Van Rooij P, Martel A, Haesebrouck F, Pasmans F. Amphibian chytridiomycosis: a review with focus on fungus-host interactions. // Veterinary Research. — 2015. — С. 1—22.
- ↑ Овчинников Р. С., Маноян М. Г., Панин А. Н. Эмерджентные грибковые инфекции животных: новые виды возбудителей // VetPharma. — 2014. — № 2. — С. 66—73.
- ↑ Коллектив авторов. Самые опасные инвазионные виды России (ТОП-100) / под ред. д. б. н., акад. Ю. Ю. Дгебуадзе, В. Г. Петросяна и Л. А. Хляп. — Москва: Litres, 2022-05-15. — С. 53—59. — 688 с. — ISBN 978-5-04-171851-0.
- ↑ CU-Boulder amphibian study shows how biodiversity can protect against disease | University of Colorado Boulder. web.archive.org (26 февраля 2013). Дата обращения: 10 сентября 2022.
- ↑ Acoustic preferences and localization performance of blood-sucking flies (Corethrella Coquillett) to túngara frog calls. academic.oup.com. Дата обращения: 12 сентября 2022.
- ↑ V. Neumann & F. Meyer: Lucilia bufonivora MONIEZ, 1876 — ein euryxener Amphibienparasit. — Mitteilungen aus dem Zoologischen Museum Berlin 70 (1994): 331—341.
- ↑ Vít Zavadil: Zum Parasitismus der Krötengoldfliege (Lucilia bufonivora MONIEZ, 1876) auf Erdkröten (Bufo bufo) — Abwehrverhalten und limitierende Faktoren. — Zeitschrift für Feldherpetologie 4 (1997): 1—12.
- ↑ Wizen G., Gasith A. (2011). «An unprecedented role reversal: ground beetle larvae (Coleoptera: Carabidae) lure amphibians and prey upon them». PLoS ONE 6 (9). doi:10.1371/journal.pone.0025161. PMID 21957480.
- ↑ 206,0 206,1 What does a salamander remember after winter?. utheses.univie.ac.at. Дата обращения: 10 сентября 2022.
- ↑ Giorgio Vallortigara, Rosa Rugani. Numerical discrimination by frogs (Bombina orientalis). Animal Cognition (2014). Дата обращения: 10 сентября 2022.
- ↑ Emmer, Rick. How do frogs survive winter? Why don't they freeze to death?. Scientific American (24 ноября 1997). Дата обращения: 15 июня 2012. Архивировано 17 августа 2012 года.
- ↑ Kayes, Sara M.; Cramp, Rebecca L.; Franklin, Craig E. Metabolic depression during aestivation in Cyclorana alboguttata (англ.) // Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology. — 2009. — Vol. 154, no. 4. — P. 557‑563. — doi:10.1016/j.cbpa.2009.09.001.
- ↑ Hudson, N. J.; Lehnert, S. A.; Ingham, A. B.; Symonds, B.; Franklin, C. E.; Harper, G. S. Lessons from an estivating frog: sparing muscle protein despite starvation and disuse (англ.) // American Physiological Society : journal. — 2005. — Vol. 290, no. 3. — P. R836‑R843. — doi:10.1152/ajpregu.00380.2005. — PMID 16239372.
- ↑ Frog Forum - African Bullfrog - Pyxicephalus adspersus - Care and Breeding. web.archive.org (15 ноября 2014). Дата обращения: 16 сентября 2022.
- ↑ Сердце лягушки. Строение и функционирование.. bio.spbu.ru. Дата обращения: 13 сентября 2022.
- ↑ frog and toad | Types, Habitat, Diet, & Characteristics | Britannica (англ.). www.britannica.com. Дата обращения: 14 сентября 2022.
- ↑ Kevin G. Smith. Effects of nonindigenous tadpoles on native tadpoles in Florida: evidence of competition (англ.) // Biological Conservation. — 2005-06-01. — Vol. 123, iss. 4. — P. 433–441. — ISSN 0006-3207. — doi:10.1016/j.biocon.2005.01.005.
- ↑ J. R. Brubacher, P. R. Ravikumar, T. Bania, M. B. Heller, R. S. Hoffman. Treatment of toad venom poisoning with digoxin-specific Fab fragments // Chest. — 1996-11. — Т. 110, вып. 5. — С. 1282–1288. — ISSN 0012-3692. — doi:10.1378/chest.110.5.1282.
- ↑ Jacek M. Szymura, Nicholas H. Barton. The Genetic Structure of the Hybrid Zone between the Fire-Bellied Toads Bombina bombina and B. variegata: Comparisons between Transects and between Loci // Evolution. — 1991. — Т. 45, вып. 2. — С. 237–261. — ISSN 0014-3820. — doi:10.2307/2409660.
- ↑ Thomas J. DeWitt, Andrew Sih, David Sloan Wilson. Costs and limits of phenotypic plasticity (англ.) // Trends in Ecology & Evolution. — 1998-02-01. — Т. 13, вып. 2. — С. 77–81. — ISSN 0169-5347. — doi:10.1016/S0169-5347(97)01274-3.
- ↑ Сербинова И. А. Размножение рогатой чесночницы (Megophrys nasuta) в Московском зоопарке // Научные исследования в зоологических парках : сборник. — 2010. — № 26. — С. 22—31. Архивировано 25 мая 2013 года.
- ↑ The Natural History and Care of the African Bullfrog. www.anapsid.org. Дата обращения: 16 сентября 2022.
- ↑ Warkentin I. G., Bickford D., Sodhi N. S., Corey J. A. Eating frogs to extinction (англ.) // Conservation Biology. — Wiley-Blackwell, 2009. — Vol. 23, no. 4. — P. 1056‑1059. — doi:10.1111/j.1523-1739.2008.01165.x.
- ↑ Cultured Aquatic Species Information Programme: Rana catesbeiana. FAO: Fisheries and Aquaculture Department. Дата обращения: 5 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Накормить Европу по-белорусски. Информационное агентство «Интерфакс-Запад» (4 марта 2009). Дата обращения: 3 сентября 2012. Архивировано 17 октября 2012 года.
- ↑ AmphibiaWeb - Conraua goliath. web.archive.org (22 марта 2012). Дата обращения: 16 сентября 2022.
- ↑ Wells, David Ames. The science of common things: a familiar explanation of the first principles of physical science. For schools, families, and young students (англ.). — Ivison, Phinney, Blakeman, 1859. — P. 290.
- ↑ Stannius ligature. Biology online (3 октября 2005). Дата обращения: 5 августа 2012. Архивировано 17 октября 2012 года.
- ↑ Sarkar, S. Lancelot Hogben, 1895–1975 (англ.) // Genetics. — 1996. — Vol. 142, no. 3. — P. 655—660. — PMID 8849876.
- ↑ Robert W. Briggs Biographical Memoir. Дата обращения: 22 апреля 2006. Архивировано 1 сентября 2006 года.
- ↑ Browder, L.; Iten, L. (Eds.). Xenopus as a Model System in Developmental Biology. Dynamic Development. University of Calgary (1998). Дата обращения: 17 июня 2012. Архивировано 17 октября 2012 года.
- ↑ Klein, S. Developing the potential of Xenopus tropicalis as a genetic model. Trans-NIH Xenopus Working Group. Дата обращения: 9 марта 2006. Архивировано 17 октября 2012 года.
- ↑ Xenopus tropicalis. Joint Genome Institute. Дата обращения: 13 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Phillipe, G., Angenot L. (2005). «Recent developments in the field of arrow and dart poisons». J Ethnopharmacol 100(1-2): 85-91.
- ↑ VanCompernolle, S. E.; Taylor, R. J.; Oswald-Richter, K.; Jiang,J.; Youree, B. E.; Bowie, J. H.; Tyler, M. J.; Conlon, M.; Wade, D.; Aiken, C.; Dermody, T. S.; KewalRamani, V. N.; Rollins-Smith, L. A.; Unutmaz, D. Antimicrobial peptides from amphibian skin potently inhibit human immunodeficiency virus infection and transfer of virus from dendritic cells to T cells (англ.) // Journal of Virology : journal. — 2005. — Vol. 79, no. 18. — P. 11598—11606. — doi:10.1128/JVI.79.18.11598-11606.2005. — PMID 16140737.
- ↑ California Schools Leading Race to Stop Dissections (25 апреля 2011). Архивировано 3 ноября 2013 года. Дата обращения 17 июня 2012.
- ↑ Lyttle, T.; Goldstein, D.; Gartz, J. Bufo toads and bufotenine: fact and fiction surrounding an alleged psychedelic (англ.) // Journal of Psychoactive Drugs : journal. — 1996. — Vol. 28, no. 3. — P. 267—290. — doi:10.1080/02791072.1996.10472488. — PMID 8895112.
- ↑ Lyttle, T. Misuse and legend in the "toad licking" phenomenon (англ.) // International Journal of Addiction. — 1993. — Vol. 28, no. 6. — P. :521—538. — PMID 8486435.
- ↑ Myers, Charles W.; Daly, John W.; Malkin, Borys. A dangerously toxic new frog (Phyllobates) used by Emberá Indians of western Colombia, with discussion of blowgun fabrication and dart poisoning (англ.) // Bulletin of the American Museum of Natural History : journal. — American Museum of Natural History, 1978. — Vol. 161. — P. 307—366.
- ↑ Whittaker, Kellie; Lyser, Shelly. Phyllobates terribilis. AmphibiaWeb (14 февраля 2005). Дата обращения: 6 августа 2012. Архивировано 17 октября 2012 года.
- ↑ Phillipe, G.; Angenot L. Recent developments in the field of arrow and dart poisons (англ.) // Journal of Ethnopharmacology : journal. — 2005. — Vol. 100, no. 1—2. — P. 85—91. — doi:10.1016/j.jep.2005.05.022. — PMID 15993556.
- ↑ 239,0 239,1 Amphibian and Avian Karyotype Evolution: Insights from Lampbrush Chromosome Studies // Genes (Basel).
- ↑ Yoshinobu Uno. Inference of evolution of vertebrate genomes and chromosomes from genomic and cytogenetic analyses using amphibians // Chromosome Science. — 2021. — Т. 24, вып. 1—2. — С. 3–12. — doi:10.11352/scr.24.3.
- ↑ Sergej Nowoshilow, Siegfried Schloissnig, Ji-Feng Fei, Andreas Dahl, Andy W. C. Pang. The axolotl genome and the evolution of key tissue formation regulators (англ.) // Nature. — 2018-02-01. — Vol. 554, iss. 7690. — P. 50–55. — ISSN 1476-4687 0028-0836, 1476-4687. — doi:10.1038/nature25458.
- ↑ 242,0 242,1 Paweł Kapusta. What do amphibian hybridization zones tell us about speciation? (неопр.). botany.pl. Дата обращения: 13 сентября 2022.
- ↑ Number of Globally Threatened Amphibian Species by Freshwater Ecoregion | Data Basin. databasin.org. Дата обращения: 30 августа 2022.
- ↑ Мисюра А.Н, Марченковская А.А. Личинки Pelophylax ridibundus (Anura, Ranidae) как очистители воды от тяжелых металлов // Працi Украiнського герпетологічного товариства. — 2009. — № 2. — С. 55–62.
- ↑ Kuzmin S. L. Commercial collecting as a threat for amphibian and reptile species of the former Soviet Union // Species. — 1994. — № 23. — P. 47–48.
- ↑ Кузьмин С.Л. Земноводные бывшего СССР. — М.: КМК, 2012. — С. 271—275. — 370 с.
- ↑ Candace Hansen. Home (англ.) ?. Amphibian Survival Alliance. Дата обращения: 30 августа 2022.
- ↑ M. Mccallum. Amphibian Decline or Extinction? Current Declines Dwarf Background Extinction Rate. — 2007. — doi:10.1670/0022-1511(2007)41[483:ADOECD]2.0.CO;2.
- ↑ PTOP Salamandra. www.salamandra.org.pl. Дата обращения: 14 сентября 2022.
- ↑ AmphibiaWeb - Rana temporaria. amphibiaweb.org. Дата обращения: 14 сентября 2022.
- ↑ Malcolm L. McCallum. [483:ADOECD2.0.CO;2.full Amphibian Decline or Extinction? Current Declines Dwarf Background Extinction Rate] // Journal of Herpetology. — 2007-09. — Т. 41, вып. 3. — С. 483–491. — ISSN 1937-2418 0022-1511, 1937-2418. — doi:10.1670/0022-1511(2007)41[483:ADOECD]2.0.CO;2.
- ↑ IUCN - Amphibian Conservation Action Plan. web.archive.org (27 апреля 2012). Дата обращения: 30 августа 2022.
- ↑ Panama Amphibian Rescue and Conservation Project » Amphibian Ark. web.archive.org (14 июня 2010). Дата обращения: 30 августа 2022.
- ↑ Phillips, Kathryn. Tracking the Vanishing Frogs (англ.). — Penguin Books, 1994. — ISBN 0-14-024646-0.
- ↑ Lips, Karen R. Decline of a tropical montane amphibian fauna (англ.) // Conservation Biology. — Wiley-Blackwell, 2008. — Vol. 12. — P. 106—117. — doi:10.1111/j.1523-1739.1998.96359.x. — .
- ↑ Frog population decrease mostly due to traffic (7 июля 2006). Архивировано 21 октября 2012 года. Дата обращения 13 июля 2012.
- ↑ Black, Richard. New frog centre for London Zoo, BBC News (2 октября 2005). Архивировано 10 декабря 2008 года. Дата обращения 3 ноября 2008.
- ↑ National recovery plan for the Southern Corroboree Frog (Pseudophryne corroboree): 5. Previous recovery actions. Environment.gov.au. Дата обращения: 3 ноября 2008. Архивировано 17 октября 2012 года.
- ↑ Bacteria show promise in fending off global amphibian killer. Physorg.com (23 мая 2007). Дата обращения: 3 ноября 2008. Архивировано 17 октября 2012 года.
- ↑ Project launched to fight frog-killing fungus, The Guardian (12 мая 2009). Архивировано 27 мая 2010 года. Дата обращения 19 июля 2009.
- ↑ 2008: Year of the Frog (15 января 2008). Дата обращения: 13 июля 2012. Архивировано 17 октября 2012 года.
- ↑ Daniel L. Bottom, Martha H. Brookes, Gordon H. Reeves. Sustainability Issues for Resource Managers. — DIANE Publishing, 1996-06. — 61 с. — ISBN 978-0-7881-4699-2.
- ↑ Игорь Акимушкин. Мир животных: птицы, рыбы, земноводные и пресмыкающиеся. — С. 360—400.
- ↑ Jaskinia Postojna - Travelmaniacy.pl. www.travelmaniacy.pl. Дата обращения: 10 сентября 2022.
- ↑ Terrarystyka.pl - Forum miłośników terrarystyki. web.archive.org (5 марта 2016). Дата обращения: 10 сентября 2022.
- ↑ Zenon Kosidowski. Opowieści biblijne.. — Warszawa: Iskry, 1968. — С. 102.
- ↑ Jan Parandowski. Mitologia : wierzenia i podania Greków i Rzymian. — Wyd. 17. — Warszawa: Czytelnik, 1979. — С. 176. — 357 pages с. — ISBN 83-07-00233-8, 978-83-07-00233-0.
- ↑ Halina Ogarek-Czoj. Mitologia Korei.. — Warszawa: Wydawnictwa Artystyczne i Filmowe, 1988. — С. 81, 108–109. — ISBN 83-221-0404-9, 978-83-221-0404-0.
- ↑ Surprises lurk inside 'Pan's Labyrinth' - USATODAY.com. usatoday30.usatoday.com. Дата обращения: 14 сентября 2022.
- ↑ Najdziwniejsze zwierzęta 2008 roku. ekologia.pl (5 января 2009). Дата обращения: 10 сентября 2022.
- ↑ Helen Meredith. X-Frogs (англ.) ?. EDGE of Existence (19 июня 2008). Дата обращения: 10 сентября 2022.
- ↑ Борейко В. Е. Биоксенофобия народных воззрений в отношении диких животных и растений. Киевский эколого-культурный центр. Дата обращения: 27 августа 2012. Архивировано 17 октября 2012 года.
- ↑ 273,0 273,1 Cooper, J.C. Symbolic and Mythological Animals (англ.). — London: Aquarian Press, 1992. — P. 106—108. — ISBN 1-85538-118-4.
- ↑ Burns, William E. Witch Hunts in Europe and America: An Encyclopedia (англ.). — Greenwood Publishing Group, 2003. — P. 7. — ISBN 0-313-32142-6.
- ↑ Berrin, Katherine; Larco Museum. The Spirit of Ancient Peru: Treasures from the Museo Arqueológico Rafael Larco Herrera (англ.). — New York: Thames and Hudson, 1997. — ISBN 0-500-01802-2.
- ↑ Gratwicke, B. The Panamanian Golden Frog. Panama Amphibian Rescue and Conservation Project (2009). Архивировано 17 октября 2012 года.
- ↑ Grzimek, 2003, p. 52.
- ↑ Аристофан. Комедии. В 2 т. / Общ. ред. Ф. А. Петровского и В. Н. Ярхо. М.: Гос. изд. худ. лит. 1954. Т. 1. 452 стр. Т. 2. 504 стр. (включает новые переводы: «Ахарняне» и «Птицы» С. Апта, «Всадники» К. Полонской, «Лягушки» Ю. Шульца)
- ↑ Brothers Grimm. The Frog Prince. East of the Web. Дата обращения: 30 июня 2012. Архивировано 17 октября 2012 года.
- ↑ Ebert, Roger. Chuck Jones: Three Cartoons (1953–1957) (15 января 2006). Архивировано 20 сентября 2012 года. Дата обращения 30 июня 2012.
- ↑ Dennys, R. The Heraldic Imagination (англ.). — 4th. — Clarkson Potter, 1998. — P. 224. — ISBN 0-5175-2629-8.
- ↑ Walk of Fame, Kermit the Frog awarded with a star on the Hollywood Walk of Fame, December 1, 2002. Walkoffame.com. Дата обращения: 30 июня 2012. Архивировано 17 октября 2012 года.
- ↑ Академия Google. scholar.google.ru. Дата обращения: 11 сентября 2022.
- ↑ Careers in Herpetology | ASIH - American Society of Ichthyology and Herpetology. web.archive.org (28 мая 2013). Дата обращения: 11 сентября 2022.
- ↑ John J. Moriarty. Society for the Study of Amphibians and Reptiles : a fifty year history, 1958 to 2007. — Salt Lake City, Utah: Society for the Study of Amphibians and Reptiles, 2007. — 60 pages с. — ISBN 978-0-916984-72-4, 0-916984-72-9.
Литература
Основная литература
- Laurie J. Vitt, Janalee P. Caldwell. Herpetology : an introductory biology of amphibians and reptiles. — 4th edition. — Amsterdam, 2014. — xiv, 757 pages с. — ISBN 978-0-12-386919-7, 0-12-386919-6.
- Жизнь животных. В 7 т. / гл. ред. В. Е. Соколов. — 2‑е изд., перераб. — М. : Просвещение, 1985. — Т. 5 : Земноводные. Пресмыкающиеся / под ред. А. Г. Банникова. — 399 с. : ил.
- Дунаев Е. А., Орлова В. Ф. Земноводные и пресмыкающиеся России. Атлас-определитель. — М.: Фитон+, 2012. — 320 с. — ISBN 978-5-93457-388-2.
- Писанец Е. М. Амфибии Украины: справочник-определитель земноводных Украины и сопредельных территорий. — Киев: Зоол. музей ННПМ НАН Украины, 2007. — 311 с.
- Grzimek, B. Grzimek’s Animal Life Encyclopedia (неопр.). — 2nd edition. — Farmington Hills: Gale Group, 2003. — Т. 6, Amphibians. — С. 3—590. — ISBN 0-7876-5362-4. (недоступная ссылка)
- Robert L. Dorit. Zoology. — Philadelphia: Saunders College Pub, 1991. — 1126 с.
- Frost D.R. et al., Megophrys nasuta. In Amphibian Species of the World: an Online Reference. Version 5.2, American Museum of Natural History, New York, USA, 2008.
- Robert F. Inger, Robert B. Stuebing: A Fieldguide to the Frogs of Borneo. Natural History Publications (Borneo), Kota Kinabalu 2005, ISBN 983-812-085-5.
Дополнительная литература
- Кузьмин С. Л. Земноводные российского Дальнего Востока / С. Л. Кузьмин, И. В. Маслова. — Российская академия наук: Научные основы сохранения биоразнообразия России, 2005. — 434 с.
- Ивантер Э. В. Земноводные и пресмыкающиеся / Э. В. Ивантер, А. В. Коросов. — Петрозаводск: Петрозаводского государственного университета, 2002. — 151 с.
- Жизнь животных / Соколов В. Е.. — Москва: Просвещение, 1985. — Т. 5. Земноводные. — 399 с.
- Кузьмин С. Л. Земноводные бывшего СССР / Рецензенты: академик РАН Э. И. Воробьёва, к. б. н. С. М. Ляпков. — М.: Товарищество научных изданий КМК, 2012. — 370 с. — 1000 экз. — ISBN 978-5-87317-871-1.
- Гуржий А. Н. Аквариумные, наземные, древесные земноводные. — Москва: Дельта-М, 2003. — 141 с.
- Stebbins R. C. A natural history of amphibians. — Princeton University Press, 1995. — 316 с.
- Бесхвостые гады // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Beltz, Ellin. Frogs: Inside their Remarkable World (англ.). — Firefly Books, 2005. — ISBN 1-55297-869-9.
- Cogger, H.G.; R.G. Zweifel, and D. Kirschner. Encyclopedia of Reptiles & Amphibians Second Edition (англ.). — Fog City Press, 2004. — ISBN 1-877019-69-0.
- Tyler, M. J. Australian Frogs A Natural History (англ.). — Reed Books, 1994. — ISBN 0-7301-0468-0.
- Blackburn D. C., Wake D. B. Class Amphibia Gray, 1825 // Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness / Zhi-Qiang Zhang (editor). — Auckland: Magnolia Press, 2011. — P. 39—55. — 237 p. — (Zootaxa). — ISBN 1175-5334.
- Grzimek B. Grzimek’s Animal Life Encyclopedia / Duellman W. E., Advisory Editor. — 2nd. — Farmington Hills: Gale Group, 2003. — P. 3—321. — ISBN 0-7876-5362-4.
Ссылки
- Амфибии, животные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890. — Т. Ia. — С. 681—682.
- АmphibiaWeb. Дата обращения: 9 сентября 2022.
- American Society of Ichthyologists and Herpetologists
- Society for the Study of Amphibians and Reptiles
- Frogs National Geographic Documentary HD на YouTube